Kiến thức chuyên môn
Axit Nitric (HNO3): Tính chất, điều chế và ứng dụng chi tiết
Axit Nitric, với công thức hóa học là HNO₃, là một trong những axit vô cơ mạnh và quan trọng bậc nhất trong ngành công nghiệp hóa chất hiện đại. Ở dạng tinh khiết, nó là một chất lỏng không màu, có khả năng bốc khói mạnh trong không khí ẩm và sở hữu các đặc tính oxy hóa cực mạnh.
Với vai trò không thể thiếu trong sản xuất phân bón, thuốc nổ, và tinh chế kim loại, việc hiểu rõ về HNO₃ là cực kỳ cần thiết. Bài viết này sẽ cung cấp một cái nhìn toàn diện và chuyên sâu về Axit Nitric, từ tính chất vật lý, hóa học, các phương pháp sản xuất công nghiệp, ứng dụng thực tiễn cho đến những lưu ý an toàn quan trọng khi sử dụng, được cập nhật mới nhất năm 2025.
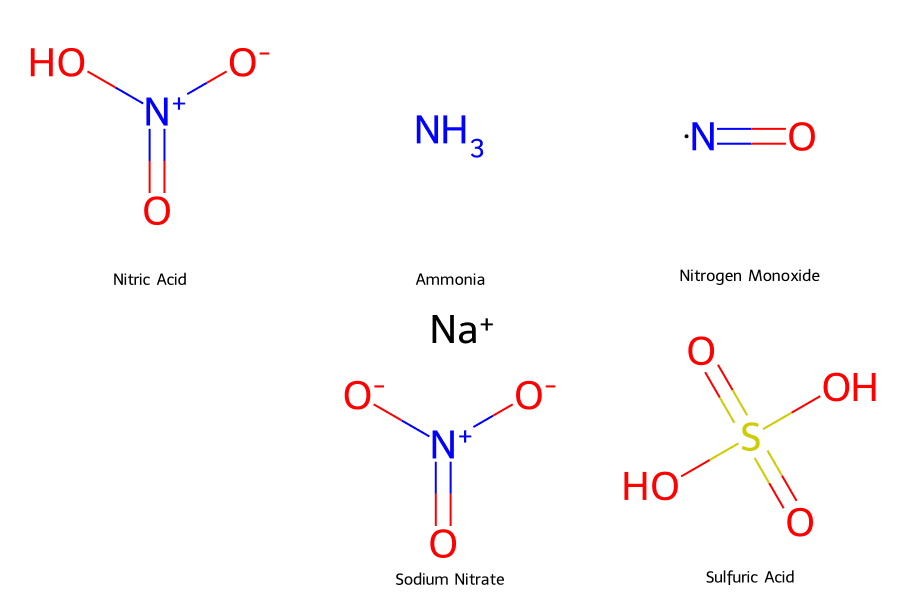
Tính Chất Vật Lý Và Hóa Học Của Axit Nitric
Axit Nitric (HNO₃) là một axit vô cơ mạnh, có tính oxy hóa vượt trội, dễ tan trong nước, dễ bay hơi và có khả năng ăn mòn hầu hết các kim loại. Về mặt vật lý, nó là chất lỏng không màu, nặng hơn nước và sôi ở 83°C.
Việc nắm vững các tính chất đặc trưng của Axit Nitric là yếu tố then chốt để có thể ứng dụng và kiểm soát nó một cách hiệu quả và an toàn.
Tính Chất Vật Lý
Axit Nitric tinh khiết là chất lỏng không màu, có tỷ trọng khoảng 1.51 g/cm³, sôi ở 83°C, tan vô hạn trong nước và là chất hút ẩm mạnh, bốc khói trong không khí ẩm.
- Trạng thái và màu sắc: HNO₃ tinh khiết là chất lỏng không màu. Tuy nhiên, các sản phẩm thương mại thường có màu vàng nhạt do sự phân hủy tự nhiên thành Nitrogen Dioxide (NO₂) khi tiếp xúc với ánh sáng.
- Khối lượng riêng và Điểm sôi: Có tỷ trọng khoảng 1.51 g/cm³, điểm đông đặc là -41.6°C và điểm sôi ở 83°C.
- Độ tan và Azeotrope: HNO₃ tan vô hạn trong nước và là một chất điện li mạnh. Nó tạo thành một hỗn hợp đẳng phí (azeotrope) với nước ở nồng độ 68%, hỗn hợp này sôi ở 120.5°C.
- Tính hút ẩm: Là một axit hút ẩm mạnh, bốc khói trắng khi để trong không khí ẩm.
Tính Chất Hóa Học
Về hóa học, HNO₃ là một monoaxit cực mạnh và là chất oxy hóa mạnh mẽ, có khả năng phản ứng với hầu hết kim loại (trừ Au, Pt) và nhiều hợp chất vô cơ, hữu cơ khác.
- Tính axit mạnh: HNO₃ là một monoaxit rất mạnh (pKa ≈ -1.3), phân ly hoàn toàn trong nước tạo thành ion H⁺ và ion nitrat (NO₃⁻).
- Tính oxy hóa mạnh: Đây là đặc tính nổi bật nhất của Axit Nitric. Nó là một chất oxy hóa mạnh, có khả năng phản ứng với hầu hết các kim loại (trừ vàng và platin). Ví dụ, phản ứng với đồng (Cu):
Cu + 4HNO₃ (đặc) ⟶ Cu(NO₃)₂ + 2NO₂ + 2H₂O - Phản ứng với phi kim: Khi đun nóng, HNO₃ đặc có thể oxy hóa nhiều phi kim như lưu huỳnh, photpho, cacbon.
- Tính kém bền: Axit Nitric dễ bị phân hủy dưới tác dụng của ánh sáng hoặc nhiệt độ, tạo thành NO₂, oxy, và nước.
- Nước cường toan (Aqua Regia): Khi trộn với Axit Clohidric (HCl) đặc theo tỉ lệ mol 1:3, hỗn hợp này được gọi là nước cường toan, có khả năng hòa tan cả vàng và bạch kim.
Các Phương Pháp Sản Xuất Axit Nitric Hiện Nay
Axit Nitric được sản xuất chủ yếu bằng phương pháp Ostwald trong công nghiệp (hiệu suất 95-98%) và điều chế bằng cách cho H₂SO₄ đặc tác dụng với NaNO₃ trong phòng thí nghiệm.
Có hai phương pháp chính để sản xuất Axit Nitric, tùy thuộc vào quy mô và mục đích sử dụng: phương pháp Ostwald trong công nghiệp và phương pháp điều chế trong phòng thí nghiệm.
1. Phương Pháp Ostwald (Sản Xuất Công Nghiệp)
Phương pháp Ostwald sản xuất HNO₃ qua ba giai đoạn: oxy hóa amoniac (NH₃) thành NO, oxy hóa NO thành NO₂, và cuối cùng là hấp thụ NO₂ bằng nước để tạo ra HNO₃.
Đây là phương pháp hiện đại và hiệu quả nhất, được sử dụng để sản xuất hàng triệu tấn HNO₃ mỗi năm. Quá trình gồm 3 giai đoạn chính:
- Giai đoạn 1: Oxy hóa Amoniac: Khí Amoniac (NH₃) được trộn với không khí và oxy hóa ở nhiệt độ 800-900°C với sự hiện diện của chất xúc tác Platin/Rhodium.
4NH₃ + 5O₂ ⟶ 4NO + 6H₂O - Giai đoạn 2: Oxy hóa Nitric Oxide: Nitric oxide (NO) sinh ra nhanh chóng bị oxy hóa bởi oxy trong không khí để tạo thành Nitrogen Dioxide (NO₂).
2NO + O₂ ⟶ 2NO₂ - Giai đoạn 3: Hấp thụ bằng nước: NO₂ được cho vào tháp hấp thụ và phản ứng với nước để tạo thành Axit Nitric.
3NO₂ + H₂O ⟶ 2HNO₃ + NO
Khí NO sinh ra từ giai đoạn 3 được tái tuần hoàn, giúp tăng hiệu suất của quá trình lên đến 95-98%.
2. Phương Pháp Phòng Thí Nghiệm
Trong phòng thí nghiệm, HNO₃ được điều chế quy mô nhỏ bằng cách đun nóng muối nitrat (NaNO₃) với Axit Sunfuric đặc, sau đó chưng cất để thu sản phẩm.
Trong quy mô nhỏ, Axit Nitric có thể được điều chế bằng cách cho Axit Sunfuric (H₂SO₄) đặc phản ứng với muối nitrat (thường là NaNO₃).
NaNO₃ + H₂SO₄ (đặc) ⟶ NaHSO₄ + HNO₃
Sau đó, tiến hành chưng cất để thu được HNO₃ tinh khiết. Phương pháp này đơn giản nhưng tiềm ẩn nhiều nguy hiểm và tạo ra khí NO₂ độc hại.
Ứng Dụng Đa Dạng Của Axit Nitric Trong Công Nghiệp
Ứng dụng chính của Axit Nitric là sản xuất phân bón (chiếm 80% sản lượng), tiếp theo là sản xuất thuốc nổ, tinh chế kim loại quý, và làm tiền chất cho nhiều hợp chất hữu cơ quan trọng.
Khoảng 80% sản lượng Axit Nitric trên toàn thế giới được dùng để sản xuất phân bón, phần còn lại được sử dụng trong nhiều lĩnh vực quan trọng khác.
- Sản xuất phân bón: HNO₃ là nguyên liệu chính để sản xuất Ammonium Nitrate (NH₄NO₃), một loại phân đạm cung cấp Nitơ hiệu quả cho cây trồng.
- Công nghiệp thuốc nổ: Được sử dụng trong quá trình nitrat hóa các hợp chất hữu cơ như Toluene để tạo ra Trinitrotoluene (TNT), hoặc nitrat hóa Glycerol để sản xuất Nitroglycerin.
- Luyện kim và tinh chế kim loại: Dùng để ăn mòn, làm sạch bề mặt kim loại trước khi xi mạ. Đặc biệt, nó được dùng để tách vàng ra khỏi các hợp kim không nguyên chất.
- Tổng hợp hóa chất hữu cơ: Là tiền chất để sản xuất Nitrobenzene (sử dụng trong sản xuất anilin) và Adipic Acid (sản xuất nylon).
- Ứng dụng khác: Dùng làm chất thử trong phòng thí nghiệm, chất đẩy cho tên lửa, và trong ngành công nghiệp sản xuất thuốc nhuộm.
Lưu Ý An Toàn Khi Sử Dụng Và Lưu Trữ Axit Nitric
An toàn là trên hết: Bắt buộc phải sử dụng đầy đủ đồ bảo hộ cá nhân (PPE), làm việc trong khu vực thông gió tốt (tủ hút), và lưu trữ Axit Nitric cách xa các chất hữu cơ, bazơ và kim loại.
Axit Nitric là một hóa chất nguy hiểm, có tính ăn mòn cao và độc hại. Việc tuân thủ nghiêm ngặt các quy tắc an toàn là bắt buộc.
Biện Pháp An Toàn Cá Nhân (PPE)
Bộ PPE tiêu chuẩn khi làm việc với HNO₃ bao gồm: kính bảo hộ chống hóa chất, găng tay nitrile, áo choàng phòng thí nghiệm và mặt nạ phòng độc nếu cần.
- Bảo vệ mắt: Luôn đeo kính bảo hộ chống hóa chất.
- Bảo vệ thân thể: Mặc áo choàng phòng thí nghiệm, tạp dề và quần áo bảo hộ chống axit.
- Bảo vệ tay: Sử dụng găng tay nitrile hoặc vật liệu chịu axit tương thích.
- Hô hấp: Làm việc trong tủ hút thông gió tốt để tránh hít phải hơi axit, có thể gây tổn thương phổi nghiêm trọng.

Xử Lý Sự Cố
Khi xảy ra sự cố, cần bình tĩnh xử lý: rửa sạch vùng da tiếp xúc với nước trong 15 phút; nếu tràn đổ, dùng bazơ yếu như NaHCO₃ để trung hòa từ từ.
- Tiếp xúc với da: Ngay lập tức rửa sạch vùng da bị ảnh hưởng dưới vòi nước chảy liên tục trong ít nhất 15 phút.
- Axit bắn vào mắt: Rửa mắt ngay lập tức với nước sạch trong 15-20 phút và tìm kiếm sự chăm sóc y tế khẩn cấp.
- Tràn đổ: Trung hòa axit tràn bằng các chất kiềm yếu như Natri Bicarbonate (NaHCO₃) hoặc vôi. Sau đó dùng vật liệu thấm hút như cát để thu gom.
Lưu Trữ và Bảo Quản
Lưu trữ HNO₃ trong bình chứa chuyên dụng (thủy tinh, HDPE), đặt ở nơi khô ráo, thoáng mát, tránh ánh nắng và phải tách biệt hoàn toàn với các chất dễ cháy.
- Vị trí: Lưu trữ ở nơi khô ráo, thoáng mát, tránh xa ánh nắng trực tiếp và nguồn nhiệt.
- Tương thích: Phải được cất giữ cách xa các chất hữu cơ, bazơ, kim loại và các chất dễ cháy để tránh phản ứng tỏa nhiệt nguy hiểm.
- Bao bì: Chứa trong các bình chứa bằng thủy tinh hoặc nhựa chống ăn mòn (HDPE) có nắp đậy kín.
Câu Hỏi Thường Gặp (FAQ)
1. Axit Nitric có nguy hiểm không?
CÓ, rất nguy hiểm. Nó là một axit ăn mòn mạnh, có thể gây bỏng nặng cho da, mắt và đường hô hấp. Luôn phải tuân thủ các quy tắc an toàn.
2. Làm cách nào để trung hòa Axit Nitric?
Sử dụng một bazơ yếu như Natri Bicarbonate (NaHCO₃). Phản ứng trung hòa sẽ xảy ra: HNO₃ + NaHCO₃ ⟶ NaNO₃ + H₂O + CO₂. Cần thực hiện từ từ và kiểm tra độ pH của dung dịch sau phản ứng.
3. Mua Axit Nitric ở đâu uy tín?
Để đảm bảo chất lượng và an toàn, bạn nên tìm đến các cửa hàng hóa chất uy tín. Hóa Chất Doanh Tín tự hào là nhà cung cấp Axit Nitric 68% chất lượng cao, đáp ứng các tiêu chuẩn an toàn nghiêm ngặt nhất.
4. Giá Axit Nitric năm 2025 là bao nhiêu?
Giá hóa chất có thể biến động. Theo dữ liệu cập nhật Quý 4/2025, thị trường Axit Nitric toàn cầu dự kiến sẽ tăng trưởng ổn định. Để có báo giá chính xác và tốt nhất, vui lòng liên hệ trực tiếp với chúng tôi.
Disclaimer: Bài viết này tổng hợp thông tin từ các nguồn đáng tin cậy nhằm mục đích tham khảo. Luôn tham vấn ý kiến chuyên gia và tuân thủ phiếu an toàn hóa chất (SDS) trước khi sử dụng Axit Nitric.





