Kiến thức chuyên môn
Chất Khử Là Gì? Cẩm Nang Toàn Diện Cho Ứng Dụng Công Nghiệp
Trong các quy trình sản xuất công nghiệp, từ luyện kim đến xử lý nước thải, việc kiểm soát các phản ứng hóa học là yếu tố sống còn. Một trong những khái niệm nền tảng nhất chính là “chất khử”. Vậy chất khử là gì và tại sao việc hiểu đúng bản chất của nó lại quan trọng đến vậy?
Bài viết này của Hóa Chất Doanh Tín sẽ không chỉ định nghĩa mà còn đi sâu vào phân loại, cơ chế hoạt động và các ứng dụng thực tiễn, giúp bạn lựa chọn và sử dụng chất khử một cách hiệu quả và an toàn nhất.
1. Chất Khử Là Gì và Bản Chất Hóa Học Của Nó Như Thế Nào?
Chất khử là một nguyên tố, ion hoặc hợp chất có khả năng nhường (cho) electron cho một chất khác trong một phản ứng hóa học, và bản thân nó sẽ bị oxi hóa.
Về cơ bản, chất khử (reducing agent) là một nguyên tố, ion hoặc hợp chất có khả năng nhường electron cho một chất khác trong một phản ứng hóa học. Quá trình này được gọi là sự oxi hóa, vì vậy, một cách chính xác hơn: Chất khử là chất bị oxi hóa.
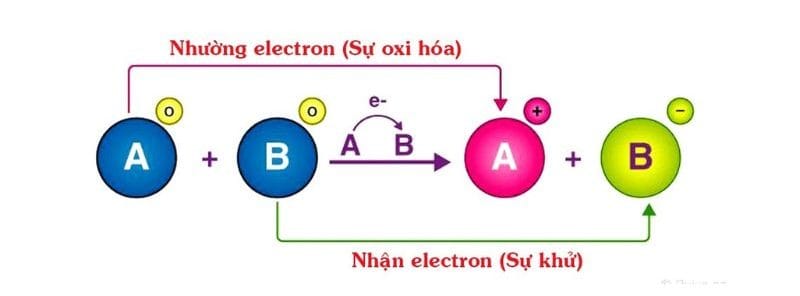
Để dễ hình dung, hãy tưởng tượng một cuộc trao đổi:
- Chất khử: “Người cho đi” electron.
- Chất oxi hóa: “Người nhận về” electron.
Quá trình này luôn xảy ra đồng thời và được gọi chung là phản ứng oxi hóa-khử.
Làm Thế Nào Để Xác Định Chất Khử Trong Một Phản Ứng?
Cách chính xác nhất để xác định chất khử là tìm chất có số oxi hóa tăng sau khi phản ứng kết thúc.
Cách chính xác nhất để xác định chất khử là dựa vào sự thay đổi số oxi hóa.
Quy tắc: Chất khử là chất có số oxi hóa tăng sau phản ứng.
Ví dụ kinh điển: Phản ứng giữa Kẽm (Zn) và axit clohydric (HCl):
Zn + 2HCl → ZnCl₂ + H₂
- Trước phản ứng: Số oxi hóa của Zn là nguyên tố gì là 0.
- Sau phản ứng: Số oxi hóa của Zn trong ZnCl₂ là +2.
Vì số oxi hóa của Zn tăng từ 0 lên +2, Zn chính là chất khử.
2. Sự Khác Biệt Giữa Chất Khử và Chất Oxi Hóa Là Gì?
Sự khác biệt cơ bản là chất khử nhường electron và bị oxi hóa, trong khi chất oxi hóa nhận electron và bị khử.
Sự nhầm lẫn giữa hai khái niệm này là rất phổ biến. Bảng dưới đây sẽ giúp bạn phân biệt rõ ràng:
| Tiêu chí | Chất Khử | Chất Oxi Hóa |
|---|---|---|
| Hành vi electron | Nhường (Cho) electron | Nhận electron |
| Quá trình xảy ra | Bị oxi hóa | Bị khử |
| Số oxi hóa | Tăng sau phản ứng | Giảm sau phản ứng |
| Thế điện cực chuẩn (E⁰) | Thường có giá trị âm hơn | Thường có giá trị dương hơn |
| Ví dụ điển hình | Kim loại (Na, Fe, Zn), H₂, CO | O₂, Halogen (Cl₂, F₂), KMnO₄, H₂SO₄ đặc |
Về bản chất, không có chất khử nếu không có chất oxi hóa và ngược lại. Chúng là hai mặt của cùng một quá trình.
3. Có Những Loại Chất Khử Công Nghiệp Phổ Biến Nào?
Các chất khử công nghiệp phổ biến bao gồm các chất gốc kim loại (như Natri), gốc Hydro và Carbon (như H₂, CO), và các hợp chất chứa Lưu huỳnh (như Natri bisulfit, Natri hydrosulfit).
Trong môi trường công nghiệp, chất khử được lựa chọn dựa trên hiệu quả, chi phí, và mức độ an toàn. Dưới đây là một số loại phổ biến nhất.
Chất Khử Gốc Kim Loại Là Gì và Có Đặc Điểm Gì?
Đây là các kim loại kiềm và kiềm thổ có tính khử rất mạnh, dễ dàng nhường electron, được dùng trong tổng hợp hữu cơ và luyện kim. Chúng thường phản ứng mạnh với nước.
Các kim loại kiềm như Natri (Na) và kiềm thổ như Magie (Mg) là những chất khử rất mạnh do chúng dễ dàng nhường electron.
- Ứng dụng: Được sử dụng trong tổng hợp hữu cơ và luyện kim để khử các oxit kim loại khó nóng chảy.
- Lưu ý: Phản ứng mạnh với nước, cần điều kiện bảo quản nghiêm ngặt.
Chất Khử Gốc Hydro và Carbon Có Vai Trò Gì?
Hydro (H₂) là chất khử sạch được dùng trong sản xuất amoniac, trong khi Carbon (C) và Carbon Monoxide (CO) là chất khử không thể thiếu trong ngành luyện kim.
- Hydro (H₂): Một chất khử sạch (sản phẩm phụ thường là nước), được dùng trong sản xuất amoniac (NH₃), hydro hóa dầu ăn.
- Carbon (C) và Carbon Monoxide (CO): Là chất khử không thể thiếu trong ngành luyện kim, đặc biệt là sản xuất gang từ quặng sắt theo phương trình:
Fe₂O₃ + 3CO → 2Fe + 3CO₂
Các Hợp Chất Chứa Lưu Huỳnh Được Dùng Làm Chất Khử Như Thế Nào?
Các hợp chất như Natri bisulfit (NaHSO₃) và Natri hydrosulfit (Na₂S₂O₄) là các chất khử quan trọng trong xử lý nước, tẩy trắng giấy, dệt may và tẩy đường.
Đây là nhóm chất khử quan trọng được cung cấp bởi Hóa Chất Doanh Tín, với ứng dụng rộng rãi.
- Natri bisulfit (NaHSO₃): Dùng trong xử lý nước để loại bỏ clo dư, và làm chất tẩy trắng trong ngành giấy, dệt may.
- Natri hydrosulfit (Na₂S₂O₄): Một chất khử rất mạnh, được dùng làm chất tẩy đường, tẩy trắng bột giấy và trong quy trình nhuộm vải.
4. Chất Khử Có Vai Trò Cốt Lõi Gì Trong Các Ngành Công Nghiệp?
Chất khử có vai trò then chốt trong nhiều ngành: loại bỏ chất ô nhiễm trong xử lý nước, tách kim loại khỏi quặng trong luyện kim, và làm chất chống oxi hóa trong thực phẩm và dược phẩm.
Hiểu được chất khử là gì sẽ không đầy đủ nếu không thấy được tầm quan trọng của chúng trong thực tiễn.
Vai Trò Của Chất Khử Trong Ngành Xử Lý Nước và Nước Thải Là Gì?
Trong xử lý nước, chất khử được dùng để loại bỏ các chất ô nhiễm độc hại, ví dụ như trung hòa clo dư thừa và khử Crom(VI) độc hại thành Crom(III) ít độc hại hơn.
Chất khử đóng vai trò then chốt trong việc loại bỏ các chất ô nhiễm độc hại.
- Khử Clo dư: Sau khi khử trùng bằng clo, lượng clo dư thừa có thể gây hại. NaHSO₃ được sử dụng để trung hòa một cách hiệu quả.
- Khử Cr(VI): Crom hóa trị 6 là một chất ô nhiễm cực độc. Các chất khử như Sắt(II) sunfat (FeSO₄) được dùng để chuyển nó thành Cr(III) ít độc hại hơn và dễ dàng kết tủa.
Chất Khử Đóng Vai Trò Gì Trong Ngành Luyện Kim?
Toàn bộ ngành luyện kim dựa trên nguyên tắc dùng chất khử (như than cốc) để tách kim loại tinh khiết ra khỏi các oxit kim loại có trong quặng.
Toàn bộ ngành công nghiệp luyện kim dựa trên nguyên tắc dùng chất khử để tách kim loại ra khỏi oxit trong quặng.
- Luyện gang: Than cốc (Carbon) khử quặng sắt trong lò cao ở nhiệt độ hàng ngàn độ C.
- Sản xuất Nhôm: Quá trình điện phân nóng chảy Al₂O₃ sử dụng cực âm (catot) bằng than chì làm chất khử.

Chất Khử Được Ứng Dụng Như Thế Nào Trong Công Nghiệp Thực Phẩm và Dược Phẩm?
Câu trả lời ngắn: Chúng được dùng làm chất chống oxi hóa (như Vitamin C) để bảo quản thực phẩm và là tác nhân quan trọng trong các phản ứng tổng hợp để tạo ra dược chất.
- Axit Ascorbic (Vitamin C): Hoạt động như một chất chống oxi hóa (một dạng chất khử) để ngăn ngừa sự hư hỏng của thực phẩm.
- Tổng hợp dược chất: Nhiều phản ứng tổng hợp hữu cơ phức tạp cần các chất khử chọn lọc như LiAlH₄ hay NaBH₄ để tạo ra các sản phẩm mong muốn.
Case Study: Giảm 30% Chi Phí Xử Lý Nước Thải cho Nhà Máy Dệt Nhuộm tại Long An
Một khách hàng của chúng tôi đã gặp vấn đề với hàm lượng màu và clo dư vượt ngưỡng trong nước thải. Sau khi khảo sát, đội ngũ kỹ thuật của Doanh Tín đã tư vấn chuyển đổi từ một loại chất khử đắt tiền sang sử dụng kết hợp Natri Hydrosulfit và Natri Bisulfit với tỷ lệ tối ưu. Kết quả: không chỉ đạt tiêu chuẩn xả thải loại A mà còn giúp khách hàng tiết kiệm 30% chi phí hóa chất hàng tháng.
5. Cần Tuân Thủ Những Tiêu Chuẩn An Toàn Nào Khi Sử Dụng và Lưu Trữ Chất Khử?
Các tiêu chuẩn an toàn chính bao gồm: luôn tuân thủ Bảng dữ liệu an toàn (MSDS), lưu trữ hóa chất đúng cách ở nơi khô ráo, tách biệt khỏi chất oxi hóa, trang bị đầy đủ đồ bảo hộ cá nhân (PPE), và tuân thủ các quy định pháp luật hiện hành như Nghị định 113/2017/NĐ-CP.
Với kinh nghiệm của Hóa Chất Doanh Tín, an toàn luôn là ưu tiên hàng đầu.
- Tuân thủ MSDS: Luôn đọc kỹ Bảng dữ liệu an toàn hóa chất (MSDS) về rủi ro, biện pháp phòng ngừa, và cách xử lý sự cố.
- Lưu trữ đúng cách: Nhiều chất khử phản ứng mạnh với độ ẩm và không khí. Cần bảo quản hóa chất trong thùng chứa kín, nơi khô ráo, thoáng mát, và tách biệt khỏi các chất oxi hóa mạnh.
- Trang bị bảo hộ cá nhân (PPE): Luôn sử dụng kính bảo hộ, găng tay chống hóa chất, và quần áo bảo hộ phù hợp khi thao tác.
- Tuân thủ quy định: Đảm bảo tuân thủ các quy định của Việt Nam, chẳng hạn như Nghị định 113/2017/NĐ-CP, về an toàn hóa chất.
Góc nhìn từ chuyên gia Nguyễn Thị Mỹ Linh, Trưởng phòng Kỹ thuật Hóa Chất Doanh Tín:
“Nhiều người chỉ tập trung vào hiệu quả khử mà quên mất yếu tố pH của dung dịch. Ví dụ, hiệu quả của Natri Bisulfit giảm mạnh trong môi trường kiềm. Một mẹo nhỏ là luôn kiểm tra và điều chỉnh pH về mức tối ưu trước khi châm hóa chất. Điều này có thể giúp bạn tiết kiệm đến 15% lượng hóa chất sử dụng.”
6. Câu Hỏi Thường Gặp (FAQ)
Làm thế nào để biết một chất là chất khử mạnh hay yếu?
Dựa vào dãy điện hóa của kim loại hoặc giá trị thế điện cực chuẩn (E⁰). Chất có E⁰ càng âm thì tính khử càng mạnh.
Chất khử có độc hại không?
Tùy thuộc vào từng chất cụ thể. Một số chất như CO rất độc, trong khi Vitamin C lại an toàn. Luôn phải tham khảo MSDS của nhà sản xuất.
Có thể mua các chất khử công nghiệp này ở đâu tại Việt Nam?
Hóa Chất Doanh Tín là nhà nhập khẩu và phân phối uy tín các loại chất khử công nghiệp với đầy đủ chứng nhận chất lượng (COA) và hỗ trợ kỹ thuật chuyên sâu.
7. Tại Sao Việc Lựa Chọn Đối Tác Cung Cấp Hóa Chất Uy Tín Lại Quan Trọng?
Lựa chọn đối tác uy tín đảm bảo bạn nhận được sản phẩm đúng chất lượng, tuân thủ các tiêu chuẩn an toàn, và quan trọng hơn là nhận được sự tư vấn kỹ thuật chuyên sâu để tối ưu hóa quy trình và chi phí sản xuất.
Việc hiểu rõ chất khử là gì không chỉ là kiến thức hóa học nền tảng mà còn là chìa khóa để tối ưu hóa quy trình sản xuất, đảm bảo an toàn và nâng cao hiệu quả kinh tế. Từ việc chọn đúng loại chất khử cho ứng dụng của bạn đến việc tuân thủ các tiêu chuẩn an toàn nghiêm ngặt, mỗi bước đều đòi hỏi sự chính xác và chuyên môn cao.
Tại Hóa Chất Doanh Tín, chúng tôi không chỉ cung cấp các sản phẩm chất khử đạt chuẩn chất lượng, mà còn mang đến giải pháp tư vấn kỹ thuật toàn diện.
Bạn cần tư vấn kỹ thuật chuyên sâu hơn?
Tải ngay tài liệu của chúng tôi để tham khảo:





