Kiến thức chuyên môn
Liên kết ion là gì? Đặc điểm, ví dụ và ứng dụng chi tiết nhất
Bạn có bao giờ tự hỏi điều gì đã giữ các hạt muối ăn (NaCl) lại với nhau thành một tinh thể hoàn hảo, hay sức mạnh nào đứng sau khả năng làm trong nước của phèn chua? Câu trả lời nằm ở một trong những lực liên kết cơ bản và mạnh mẽ nhất của tự nhiên: liên kết ion.
Đây không chỉ là một khái niệm hóa học trong sách giáo khoa. Đối với ngành công nghiệp, việc hiểu rõ bản chất “liên kết ion là gì” chính là chìa khóa để tối ưu hóa quy trình sản xuất, lựa chọn nguyên liệu và đảm bảo chất lượng sản phẩm. Với kinh nghiệm của một chuyên gia trong ngành, Hóa Chất Doanh Tín sẽ cùng bạn giải mã toàn bộ về loại liên kết quan trọng này.
Định nghĩa liên kết ion từ góc nhìn chuyên gia là gì?
Bản chất của liên kết ion là gì?
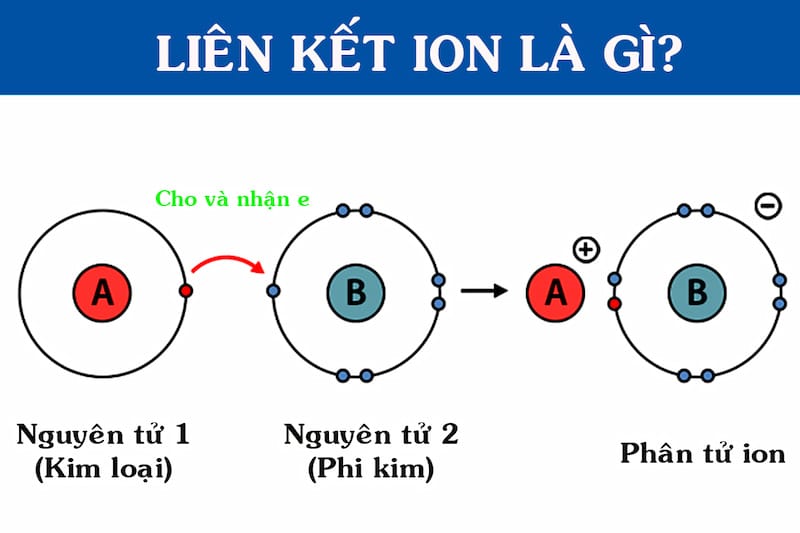
Liên kết ion là lực hút tĩnh điện mạnh mẽ giữa hai ion mang điện tích trái dấu (cation và anion), được hình thành do sự cho và nhận hoàn toàn electron giữa các nguyên tử.
Hãy tưởng tượng nó như hai đầu nam châm khác cực hút chặt lấy nhau. Lực hút này được hình thành khi một nguyên tử nhường hẳn electron cho một nguyên tử khác, thay vì dùng chung như trong liên kết cộng hóa trị. Nguyên tử nhường electron sẽ có số proton nhiều hơn electron, trở thành ion dương (gọi là cation). Ngược lại, nguyên tử nhận electron sẽ có số electron nhiều hơn proton, trở thành ion âm (gọi là anion). Chính lực hút tĩnh điện cực mạnh giữa các cation và anion này đã tạo nên một liên kết bền vững.
Làm thế nào để phân biệt Ion, Cation và Anion?
Ion là nguyên tử mang điện. Cation là ion dương (mất electron), thường là kim loại. Anion là ion âm (nhận electron), thường là phi kim.
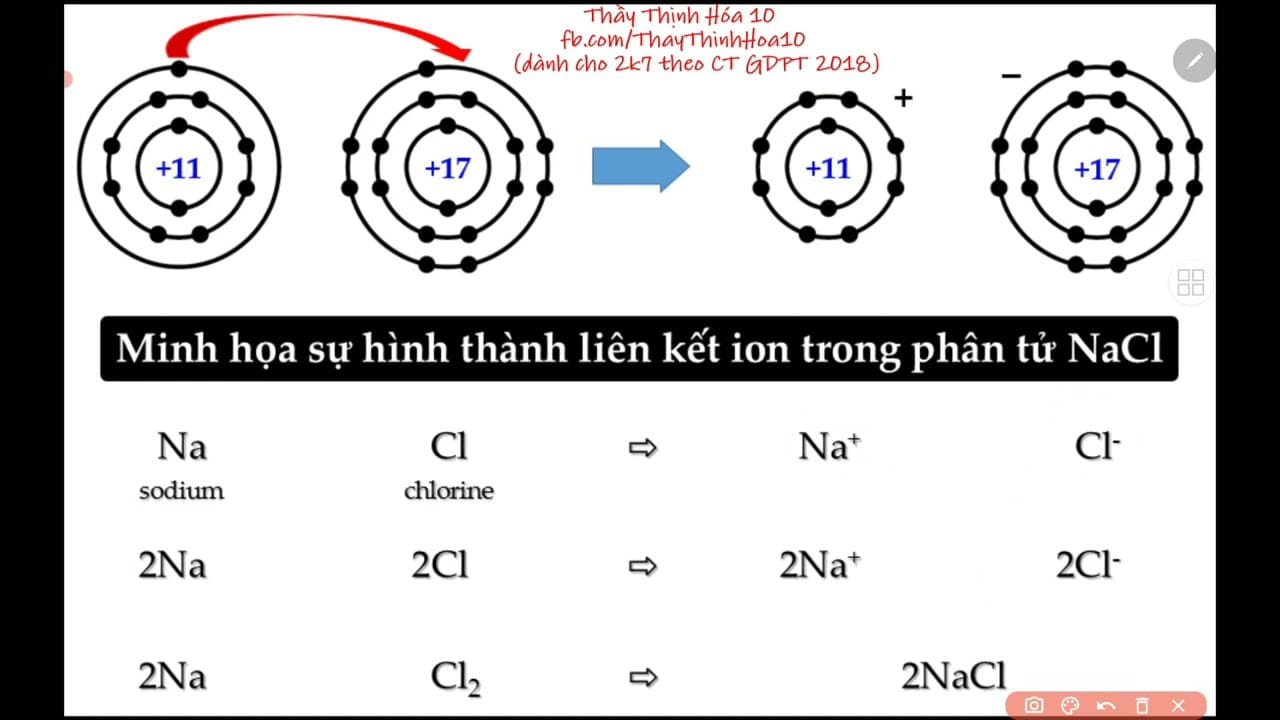
Để hiểu rõ liên kết ion, việc nắm vững các khái niệm nền tảng này là rất quan trọng. Ion là một nguyên tử hoặc một nhóm nguyên tử bị mất hoặc nhận thêm electron, do đó mang điện tích. Cation (Ion dương) thường được hình thành từ các nguyên tử kim loại (như Natri (Na), Ca, Al) do chúng có xu hướng nhường electron ở lớp ngoài cùng. Ví dụ: Na → Na⁺ + 1e⁻. Anion (Ion âm) thường được hình thành từ các nguyên tử phi kim (như Clo (Cl), O, S) do chúng có xu hướng nhận thêm electron để lấp đầy lớp ngoài cùng. Ví dụ: Cl + 1e⁻ → Cl⁻.
Quy trình hình thành liên kết ion diễn ra như thế nào?
Điều kiện cần và đủ để tạo liên kết ion là gì?
Cần có sự kết hợp giữa một kim loại điển hình và một phi kim điển hình, với hiệu độ âm điện giữa chúng phải lớn hơn hoặc bằng 1.7.
Liên kết ion không hình thành một cách ngẫu nhiên. Nó đòi hỏi những điều kiện cụ thể. Hai điều kiện chính là: Sự khác biệt về tính chất, liên kết thường xảy ra giữa một kim loại điển hình (dễ nhường electron) và một phi kim điển hình (dễ nhận electron). Thứ hai là Hiệu độ âm điện (Δχ), theo thang đo Pauling, giá trị này phải lớn hơn hoặc bằng 1.7. Bạn có thể tra cứu các giá trị độ âm điện trong bảng tuần hoàn hóa học.
Năng lượng mạng lưới có vai trò gì trong việc đo độ bền liên kết ion?
Năng lượng mạng lưới là thước đo trực tiếp độ bền của liên kết ion; năng lượng này càng lớn thì liên kết càng bền và nhiệt độ nóng chảy của hợp chất càng cao.
Điều gì quyết định một hợp chất ion bền vững hơn hợp chất khác? Câu trả lời là năng lượng hoạt hóa và năng lượng mạng lưới. Đây là năng lượng giải phóng ra khi các ion ở thể khí kết hợp lại tạo thành một mol tinh thể. Năng lượng này phụ thuộc vào hai yếu tố chính: điện tích ion (điện tích càng lớn, lực hút càng mạnh) và bán kính ion (bán kính càng nhỏ, lực hút càng mạnh). Ví dụ, MgO (ion Mg²⁺ và O²⁻) có nhiệt độ nóng chảy (2852°C) cao hơn nhiều so với NaCl (ion Na⁺ và Cl⁻) (801°C) vì ion trong MgO có điện tích lớn hơn.
Mạng tinh thể ion là gì và cấu trúc của nó ra sao?
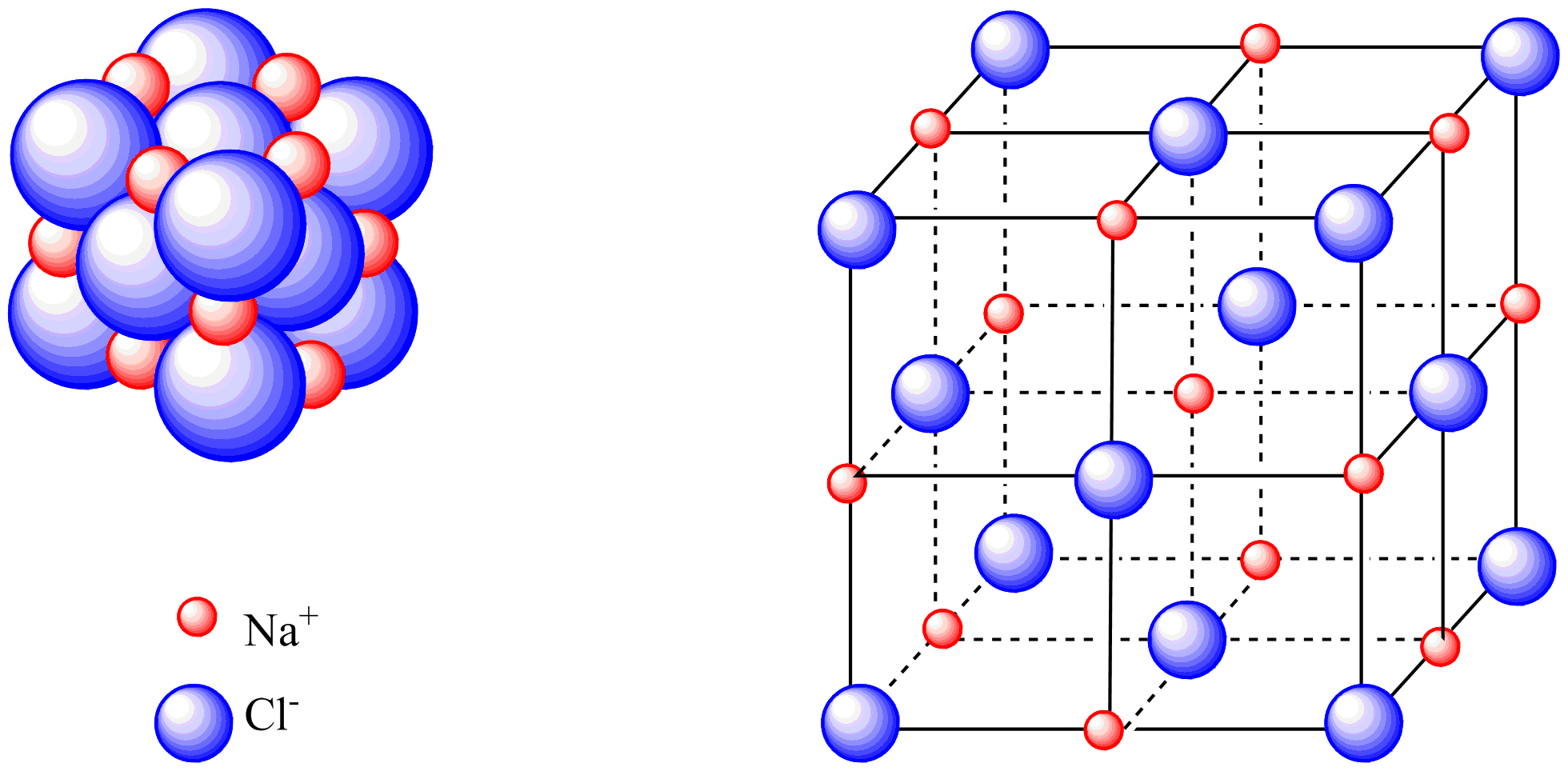
Câu trả lời ngắn: Đó là một cấu trúc không gian ba chiều khổng lồ, trong đó các cation và anion được sắp xếp xen kẽ, đều đặn và liên kết với nhau bằng lực hút tĩnh điện đa hướng.
Các hợp chất ion không tồn tại dưới dạng các phân tử riêng lẻ. Thay vào đó, hàng tỷ tỷ ion Na⁺ và Cl⁻ sắp xếp theo một trật tự hình học chặt chẽ gọi là mạng tinh thể ion. Trong tinh thể NaCl, mỗi ion Na⁺ được bao quanh bởi 6 ion Cl⁻, và ngược lại. Cấu trúc trật tự này tạo ra một khối thống nhất, cực kỳ bền vững.
Những tính chất vật lý đặc trưng của hợp chất ion là gì?
Tại sao hợp chất ion thường ở trạng thái rắn và có nhiệt độ nóng chảy cao?
Do lực hút tĩnh điện trong mạng tinh thể cực kỳ mạnh, cần một năng lượng rất lớn để phá vỡ cấu trúc này và làm các ion chuyển động tự do.
Đây là lý do tại sao hầu hết các hợp chất ion đều ở trạng thái rắn ở điều kiện thường và có nhiệt độ nóng chảy cũng như nhiệt độ sôi rất cao. Để phá vỡ các liên kết bền vững này đòi hỏi phải cung cấp một lượng nhiệt năng đáng kể.
Tại sao hợp chất ion lại cứng nhưng giòn và dễ vỡ?
Chúng cứng vì các ion bị giữ chặt. Nhưng khi một lực mạnh tác động làm dịch chuyển các lớp ion, các ion cùng dấu sẽ thẳng hàng, tạo ra lực đẩy mạnh làm phá vỡ tinh thể.
Mạng tinh thể ion rất cứng vì các ion bị khóa chặt ở vị trí của chúng. Tuy nhiên, chúng lại rất giòn. Khi có lực tác động, một lớp ion bị trượt đi. Điều này khiến các ion cùng dấu bị đẩy đến gần nhau. Lực đẩy tĩnh điện giữa chúng đột ngột tăng lên, khiến cho toàn bộ cấu trúc tinh thể bị phá vỡ dọc theo mặt phẳng trượt đó.
Khả năng dẫn điện đặc trưng của hợp chất ion là gì?
Hợp chất ion không dẫn điện ở trạng thái rắn nhưng dẫn điện tốt khi nóng chảy hoặc hòa tan trong nước, vì khi đó các ion có thể di chuyển tự do.
Khả năng dẫn điện của hợp chất ion phụ thuộc vào trạng thái của nó, đây là một đặc tính quan trọng của chất điện li. Ở trạng thái rắn, các ion bị khóa chặt trong mạng lưới và không thể di chuyển. Tuy nhiên, khi nóng chảy hoặc tan trong một dung môi như nước để tạo thành dung dịch, các ion được giải phóng và có thể di chuyển tự do để tạo thành dòng điện.
So sánh chuyên sâu giữa liên kết ion và liên kết cộng hóa trị có gì khác biệt?
Sự khác biệt cốt lõi là liên kết ion dựa trên sự “cho-nhận” hoàn toàn electron và lực hút tĩnh điện, trong khi liên kết cộng hóa trị dựa trên sự “dùng chung” các cặp electron.
Hiểu rõ sự khác biệt giúp chúng ta dự đoán được tính chất và ứng dụng của các loại hợp chất khác nhau. Dưới đây là bảng so sánh chi tiết:
| Tiêu Chí | Liên Kết Ion | Liên Kết Cộng Hóa Trị |
|---|---|---|
| Bản chất | Nhường và nhận hẳn electron, tạo lực hút tĩnh điện. | Góp chung electron. |
| Hiệu độ âm điện (Δχ) | ≥ 1.7 | < 1.7 |
| Cấu trúc | Mạng tinh thể ion. | Phân tử riêng lẻ. |
| Tính tan | Thường tan tốt trong dung môi phân cực (nước). Xem chi tiết trong bảng tính tan. | Tan tốt trong dung môi không phân cực. |
| Khả năng dẫn điện | Dẫn điện khi nóng chảy hoặc trong dung dịch. | Thường không dẫn điện. |
Ứng dụng thực tiễn của các hợp chất ion trong công nghiệp là gì?
Chúng là nền tảng của nhiều hóa chất công nghiệp quan trọng như muối, xút, chất trợ lắng trong xử lý nước, và các chất hút ẩm, đóng vai trò cốt lõi trong nhiều quy trình sản xuất.
Tại Hóa Chất Doanh Tín, chúng tôi không chỉ cung cấp sản phẩm mà còn mang đến giải pháp dựa trên sự am hiểu sâu sắc về bản chất hóa học. Các hợp chất ion là nền tảng của nhiều sản phẩm thiết yếu:
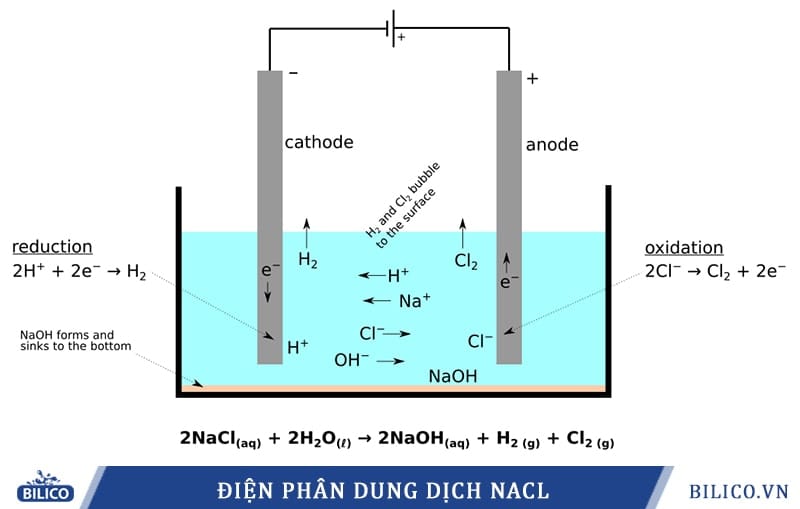
- Natri Clorua (NaCl – Muối công nghiệp): Nguyên liệu cốt lõi để sản xuất Xút (NaOH) và Khí Clo (Cl₂), tuân thủ các quy định pháp luật về quản lý Clo.
- Canxi Clorua (CaCl₂): Dùng làm chất chống đông, chất hút ẩm trong công nghiệp.
- Poly Aluminium Chloride (PAC): Hóa chất trợ lắng quan trọng trong xử lý nước thải và nước cấp, hoạt động hiệu quả khi kết hợp với Polymer Cation.
- Xút (NaOH): Hóa chất nền tảng trong ngành giấy, dệt nhuộm, sản xuất xà phòng.
Case Study: Tối ưu hóa quy trình xử lý nước thải bằng PAC cho thấy hiệu quả của tương tác ion như thế nào?
Các ion đa nhân mang điện tích dương cao của PAC đã trung hòa và kết tụ hiệu quả các hạt màu mang điện tích âm trong nước thải, giúp tăng hiệu quả xử lý màu 30% và giảm 25% chi phí hóa chất.
- Thách thức: Một nhà máy dệt nhuộm lớn tại Bình Dương đối mặt với vấn đề nước thải có độ màu và COD cao, khó xử lý bằng các phương pháp truyền thống.
- Giải pháp của Doanh Tín: Chúng tôi tư vấn sử dụng PAC dạng lỏng. Bản chất ion của PAC với các chuỗi polymer mang điện tích dương cao đã nhanh chóng trung hòa và gây kết tụ các hạt màu (mang điện tích âm) trong nước thải.
- Kết quả: Hiệu quả xử lý màu tăng 30%, giảm 25% chi phí hóa chất so với phèn nhôm sunfat truyền thống, nước đầu ra đạt tiêu chuẩn TCVN.
- Bài học: Việc hiểu rõ tương tác ion giữa chất trợ lắng và chất bẩn là yếu tố quyết định đến hiệu quả xử lý.
Góc Nhìn Chuyên Gia
Từ Nguyễn Thị Mỹ Linh, Giám đốc Kỹ thuật Hóa Chất Doanh Tín:
“Trong thực tế công nghiệp, việc hiểu rõ bản chất liên kết ion giúp chúng tôi kiểm soát chất lượng nguyên liệu đầu vào. Ví dụ, cấu trúc tinh thể của muối công nghiệp ảnh hưởng trực tiếp đến tốc độ hòa tan và hiệu suất trong các phản ứng điện phân. Đó không chỉ là lý thuyết, đó là yếu tố cốt lõi của hiệu quả sản xuất.”
Các câu hỏi thường gặp (FAQ) về liên kết ion là gì?
Mọi hợp chất giữa kim loại và phi kim có phải đều là hợp chất ion không?
Không hẳn. Một số hợp chất như BeCl₂ hay AlCl₃ có liên kết mang nhiều đặc tính cộng hóa trị hơn do hiệu độ âm điện không quá lớn. Liên kết hóa học là một dải liên tục.
Làm sao để so sánh độ bền của hai hợp chất ion khác nhau?
Dựa vào năng lượng mạng lưới. Hợp chất có ion điện tích lớn hơn và bán kính nhỏ hơn thường sẽ có năng lượng mạng lưới lớn hơn, bền hơn và nhiệt độ nóng chảy cao hơn.
Tại sao muối ăn lại tan được trong nước?
Vì các phân tử nước phân cực sẽ bao quanh các ion Na⁺ và Cl⁻, lực tương tác này đủ mạnh để phá vỡ mạng tinh thể và hòa tan chúng.
Tải Về Nhanh
Để tiện tra cứu, chúng tôi đã tổng hợp toàn bộ kiến thức cốt lõi vào một tài liệu duy nhất.
Kết luận lại, tầm quan trọng của liên kết ion là gì?
Liên kết ion không chỉ là một định nghĩa trong hóa học mà là một lực lượng định hình nên vô số vật liệu và quy trình trong cuộc sống cũng như công nghiệp. Từ độ cứng của một tinh thể đến khả năng dẫn điện của một dung dịch, tất cả đều bắt nguồn từ lực hút tĩnh điện đơn giản giữa các ion trái dấu. Việc nắm vững kiến thức về liên kết ion là gì và các tính chất liên quan giúp chúng ta không chỉ giải thích được các hiện tượng tự nhiên mà còn làm chủ công nghệ, tạo ra các sản phẩm chất lượng cao. Nếu bạn có bất kỳ thắc mắc nào về việc lựa chọn hoặc ứng dụng các hóa chất công nghiệp, đội ngũ chuyên gia của Hóa Chất Doanh Tín luôn sẵn sàng tư vấn.
Lưu ý: Thông tin trong bài viết chỉ mang tính chất tham khảo học thuật và công nghiệp. Để được tư vấn kỹ thuật chi tiết cho ứng dụng cụ thể của bạn, vui lòng liên hệ trực tiếp với Hóa Chất Doanh Tín.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →





