Kiến thức chuyên môn
Ete là gì? Cấu trúc, Tính chất & Ứng dụng Công nghiệp
Trong thế giới hóa học công nghiệp và nghiên cứu, ete không chỉ là một nhóm hợp chất hữu cơ cơ bản mà còn là một công cụ không thể thiếu, đóng vai trò từ dung môi phản ứng đến thành phần dược phẩm. Tuy nhiên, để khai thác tối đa tiềm năng và đảm bảo an toàn tuyệt đối khi sử dụng, việc hiểu rõ bản chất của ete là yêu cầu tiên quyết.
Hóa Chất Doanh Tín, với kinh nghiệm 20 năm trong ngành, sẽ cung cấp một cái nhìn chuyên sâu và toàn diện về ete – không chỉ là định nghĩa “Ete là gì?” mà còn là những kiến thức kỹ thuật ứng dụng trực tiếp vào sản xuất và nghiên cứu tại Việt Nam.
1. Cấu trúc và danh pháp của Ete được xác định như thế nào?
Ete là hợp chất hữu cơ có công thức tổng quát R–O–R’, trong đó một nguyên tử oxy liên kết với hai gốc hydrocarbon. Danh pháp của chúng được xác định theo tên thông thường (tên 2 gốc + “ete”) hoặc theo IUPAC (gốc nhỏ hơn làm nhóm thế “alkoxy”).
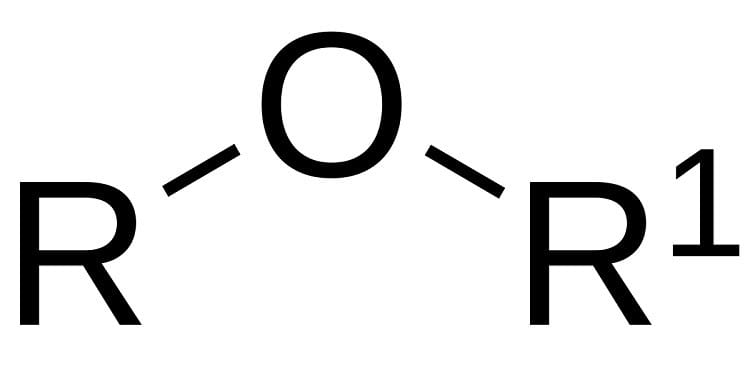
Về cơ bản, ete là các hợp chất hữu cơ mà trong đó, một nguyên tử oxy liên kết với hai gốc hydrocarbon (ký hiệu là R và R’). Công thức tổng quát của chúng là R–O–R’.
- Ete đối xứng: Khi hai gốc hydrocarbon giống hệt nhau (R = R’). Ví dụ: CH₃-CH₂–O–CH₂-CH₃ (Diethyl ether).
- Ete không đối xứng: Khi hai gốc hydrocarbon khác nhau (R ≠ R’). Ví dụ: CH₃–O–CH₂-CH₃ (Ethyl methyl ether).
Cấu trúc không gian của liên kết C–O–C không phải là đường thẳng mà tạo thành một góc khoảng 110°. Điều này, kết hợp với độ âm điện của oxy, tạo ra một momen lưỡng cực nhỏ, khiến ete có tính phân cực yếu. Chính đặc điểm cấu trúc này quyết định phần lớn các tính chất vật lý và hóa học đặc trưng của chúng.
Danh pháp theo IUPAC và Tên Thông Thường được quy định ra sao?
Để xác định chính xác hóa chất, ete được gọi tên theo hai cách chính: Tên thông thường liệt kê các gốc hydrocarbon theo thứ tự bảng chữ cái cộng với “ete”, trong khi Tên IUPAC coi gốc nhỏ hơn là nhóm thế “alkoxy” gắn vào mạch chính dài hơn.
Việc gọi tên ete rất quan trọng để xác định chính xác hóa chất.
- Tên thông thường: Tên của hai gốc hydrocarbon được liệt kê theo thứ tự bảng chữ cái, theo sau là từ “ete”. Ví dụ: Diethyl ether, Methyl tert-butyl ether (MTBE).
- Danh pháp IUPAC: Gốc OR’ nhỏ hơn được coi là nhóm thế “alkoxy”, gắn vào mạch hydrocarbon chính dài hơn. Ví dụ: CH₃–O–CH₂CH₃ được gọi là Methoxyethane.
2. Tính chất vật lý của Ete là gì và ảnh hưởng đến ứng dụng ra sao?
Các tính chất vật lý đặc trưng của ete bao gồm nhiệt độ sôi thấp, khả năng bay hơi cao, độ tan trong nước hạn chế và tính phân cực yếu. Những đặc điểm này quyết định trực tiếp đến cách lưu trữ và ứng dụng của chúng trong công nghiệp, đặc biệt là vai trò làm dung môi.
Các tính chất vật lý của ete ảnh hưởng trực tiếp đến cách chúng được lưu trữ, sử dụng và ứng dụng trong công nghiệp.
Tại sao Ete có nhiệt độ sôi thấp và dễ bay hơi?
Ete dễ bay hơi và có nhiệt độ sôi thấp do phân tử của chúng không chứa nhóm hydroxyl (-OH), dẫn đến việc không thể tự tạo liên kết hydro bền vững với nhau. Lực tương tác giữa các phân tử ete rất yếu.
Một trong những đặc điểm nổi bật nhất của ete là có nhiệt độ sôi thấp so với các ancol có cùng khối lượng phân tử. Lực tương tác giữa các phân tử ete chủ yếu là lực Van der Waals yếu, cần ít năng lượng để phá vỡ. Đặc tính dễ bay hơi này làm cho ete trở thành dung môi lý tưởng cho quá trình chiết xuất và chưng cất.
Vì sao ete có thể tan một phần trong nước?
Mặc dù không thể tự liên kết hydro với nhau, nguyên tử oxy trong ete vẫn còn cặp electron tự do, cho phép nó tạo liên kết hydro yếu với các phân tử nước. Điều này giải thích khả năng tan một phần của các ete có phân tử khối nhỏ.
Điều này giải thích tại sao các ete có phân tử khối nhỏ tan được một phần trong nước, một khái niệm cơ bản về độ tan.
Tính phân cực và khả năng làm dung môi của ete như thế nào?
Ete là dung môi phân cực aprotic yếu, có khả năng hòa tan tốt nhiều hợp chất không phân cực (dầu, sáp) và một số hợp chất phân cực. Tính trơ hóa học kết hợp với khả năng này làm cho chúng trở thành môi trường lý tưởng cho nhiều phản ứng hóa học.
Góc nhìn chuyên gia – Nguyễn Thị Mỹ Linh, Trưởng phòng Kỹ thuật Hóa Chất Doanh Tín:
“Nhiều khách hàng thường phân vân giữa việc chọn ete và một dung môi khác như acetone (MEK). Điểm mấu chốt nằm ở tính trơ. Trong các phản ứng nhạy cảm với nhóm carbonyl, như phản ứng Grignard, ete là lựa chọn vàng vì nó không phản ứng với thuốc thử. Việc lựa chọn sai dung môi có thể làm hỏng cả một mẻ sản xuất lớn. Đó là lý do chúng tôi luôn tư vấn kỹ thuật cặn kẽ cho từng ứng dụng cụ thể của khách hàng.”
3. Tính chất hóa học nổi bật của Ete là gì?
Ete tương đối trơ về mặt hóa học, nhưng chúng có các phản ứng đặc trưng như bị phân cắt bởi axit mạnh (HBr, HI), tự oxy hóa tạo thành peroxide gây nổ khi tiếp xúc với không khí và ánh sáng, và tham gia phản ứng thế trên vòng thơm đối với aryl ete.
So với các nhóm chức khác, liên kết ete (C–O–C) khá bền vững. Tuy nhiên, trong những điều kiện khắc nghiệt, chúng vẫn có những phản ứng đặc trưng.
Phản ứng quan trọng nhất của ete là gì?
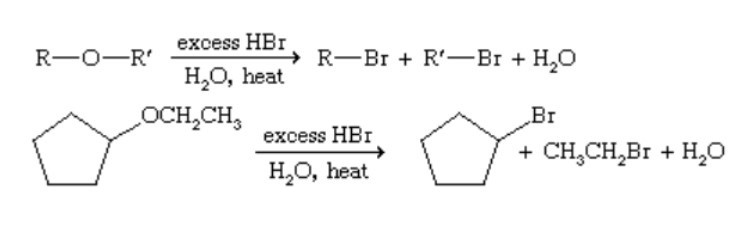
Phản ứng quan trọng và đặc trưng nhất của ete là phản ứng phân cắt liên kết C–O–C khi đun nóng với các axit mạnh không chứa oxy như Axit bromhidric (HBr) hoặc HI, tạo ra ancol và alkyl halide.
Khi đun nóng với các axit mạnh như Axit bromhidric (HBr), liên kết ete sẽ bị phá vỡ. Công thức phản ứng chung là: R–O–R’ + HX → R–OH + R’–X. Cơ chế phản ứng (SN1 hoặc SN2) phụ thuộc vào bậc của các nguyên tử carbon gắn với oxy.
Rủi ro tiềm ẩn lớn nhất khi sử dụng ete là gì?
Rủi ro nguy hiểm nhất là khả năng tự oxy hóa của ete khi tiếp xúc lâu ngày với không khí và ánh sáng. Quá trình này tạo ra hydroperoxide và peroxide, là những chất oxy hóa cực kỳ không ổn định và dễ gây nổ.
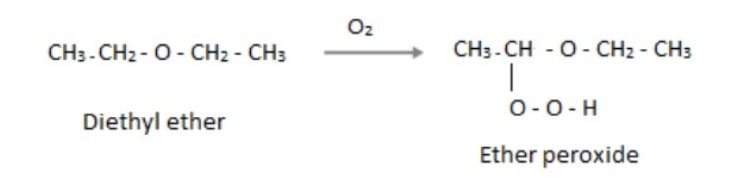
Việc bảo quản hóa chất đúng cách là tối quan trọng. Luôn lưu trữ ete trong chai tối màu, đậy kín, và ghi rõ ngày mở nắp.
Aryl ete tham gia phản ứng hóa học như thế nào?
Đối với các ete có vòng thơm (aryl ete), nhóm alkoxy (–OR) hoạt động như một nhóm hoạt hóa vòng, làm tăng khả năng phản ứng thế và định hướng các nhóm thế mới vào vị trí ortho và para.
Đối với các ete có vòng thơm (ví dụ: Anisole), nhóm alkoxy (–OR) là một nhóm hoạt hóa vòng và định hướng thế vào vị trí ortho và para khi phản ứng với các chất như Brom (Br₂).
4. Các phương pháp điều chế Ete phổ biến trong công nghiệp là gì?
Hai phương pháp điều chế ete phổ biến nhất là phương pháp khử nước từ ancol (thường dùng để tạo ete đối xứng) và phương pháp tổng hợp Williamson (linh hoạt hơn, dùng để tạo ete đối xứng và không đối xứng).
Làm thế nào để điều chế ete từ ancol?
Ete đối xứng có thể được điều chế bằng cách đun nóng các ancol bậc I như ethanol (ancol etylic) ở khoảng 140°C với sự có mặt của chất xúc tác axit mạnh như axit sunfuric (H₂SO₄) đậm đặc để loại bỏ một phân tử nước.
Phương pháp này hiệu quả cho việc điều chế các ete đối xứng từ ancol bậc I.
Ưu điểm của phương pháp tổng hợp Williamson là gì?
Phương pháp tổng hợp Williamson có tính linh hoạt vượt trội, cho phép điều chế hiệu quả các loại ete không đối xứng thông qua phản ứng thế nucleophin (cơ chế SN2) giữa một ion alkoxide và một alkyl halide.
Case Study của Doanh Tín:
“Một khách hàng trong ngành dược phẩm cần tổng hợp một ete không đối xứng đặc thù. Đội ngũ kỹ thuật của Doanh Tín đã tư vấn cho họ chuyển sang quy trình tổng hợp Williamson. Kết quả: hiệu suất tăng từ 35% lên 85%, giảm đáng kể chi phí tinh chế.”
5. Các ứng dụng thực tiễn của Ete trong công nghiệp là gì?
Ete có ứng dụng rộng rãi trong nhiều ngành công nghiệp: làm dung môi cho hóa chất, chất béo, nhựa; trong y tế từng là thuốc gây mê; trong ngành năng lượng là phụ gia xăng; và trong các ngành khác như sản xuất nước hoa, môi trường truyền nhiệt.

Nhờ các tính chất đặc trưng, ete có mặt trong rất nhiều lĩnh vực sản xuất.
- Ngành Dung môi & Hóa chất: Diethyl ether và Tetrahydrofuran (THF) là những dung môi quan trọng, bên cạnh các loại khác như Toluene và Xylene.
- Ngành Dược phẩm & Y tế: Từng là thuốc gây mê, dung môi chiết xuất.
- Ngành Nhiên liệu & Năng lượng: Methyl tert-butyl ether (MTBE) từng là phụ gia xăng phổ biến.
- Ngành khác: Môi trường truyền nhiệt, sản xuất nước hoa.
| Đặc tính | Diethyl Ether (DEE) | Methyl t-Butyl Ether (MTBE) | Tetrahydrofuran (THF) |
|---|---|---|---|
| Nhiệt độ sôi | 34.6°C | 55.2°C | 66°C |
| Độ phân cực | Thấp | Thấp | Trung bình |
| Độ tan trong nước | 6.9 g/100mL | 4.2 g/100mL | Tan hoàn toàn |
| Ứng dụng chính | Dung môi chiết xuất, phản ứng Grignard | Phụ gia xăng (cũ), dung môi | Dung môi PVC, polymer, keo dán |
| Lưu ý an toàn | Tạo peroxide, rất dễ cháy | Gây ô nhiễm nguồn nước ngầm | Tạo peroxide, dễ cháy |
6. Cần tuân thủ những quy định và tiêu chuẩn nào khi làm việc với Ete tại Việt Nam?
Khi làm việc với ete tại Việt Nam, bắt buộc phải tuân thủ các quy định pháp luật hiện hành như Nghị định 113/2017/NĐ-CP của Luật Hóa chất, TCVN 5507:2002 về quy tắc an toàn, và các quy định về việc ghi nhãn hóa chất theo Hệ thống hài hòa toàn cầu GHS.
- Nghị định 113/2017/NĐ-CP: Quy định chi tiết và hướng dẫn thi hành một số điều của Luật Hóa chất.
- TCVN 5507:2002: Hóa chất nguy hiểm – Quy tắc an toàn trong sản xuất, kinh doanh, sử dụng.
- Hệ thống GHS: Việc ghi nhãn hóa chất theo GHS là yêu cầu bắt buộc để cảnh báo các rủi ro.
Doanh Tín cam kết mọi sản phẩm từ cửa hàng hóa chất của chúng tôi đều có đầy đủ Phiếu an toàn hóa chất (MSDS) bằng tiếng Việt, tuân thủ mọi quy định của pháp luật Việt Nam.
7. Câu Hỏi Thường Gặp (FAQ)
Ete có độc không?
Có, hơi ete có thể gây độc. Hít phải ở nồng độ cao có thể gây chóng mặt, buồn nôn và ảnh hưởng đến hệ thần kinh trung ương. Cần phải sử dụng trong môi trường thông thoáng và có trang bị bảo hộ cá nhân (PPE).
Làm thế nào để bảo quản ete an toàn?
Để bảo quản ete an toàn, cần lưu trữ trong chai tối màu, đậy nắp kín, đặt ở nơi khô ráo, thoáng mát, và phải tuyệt đối tránh xa các nguồn nhiệt, tia lửa hoặc ánh sáng mặt trời trực tiếp. Ghi rõ ngày mở nắp lên chai là một yêu cầu bắt buộc.
Sự khác biệt chính giữa ete và este là gì?
Sự khác biệt cơ bản nằm ở cấu trúc và tính chất hóa học. Ete có cấu trúc R-O-R’ và tương đối trơ. Trong khi đó, este có cấu trúc R-COO-R’ (chứa nhóm carbonyl) và dễ dàng tham gia phản ứng thủy phân, ví dụ điển hình là etyl axetat.
Kết luận
Việc hiểu rõ “Ete là gì?” không chỉ dừng lại ở công thức R-O-R’ mà còn là việc nắm vững các tính chất, ứng dụng, và đặc biệt là các quy tắc an toàn. Tại Hóa Chất Doanh Tín, chúng tôi không chỉ cung cấp các sản phẩm ete chất lượng cao mà còn là người đồng hành, tư vấn để khách hàng có thể lựa chọn và sử dụng sản phẩm một cách hiệu quả và an toàn nhất.
Bạn cần tư vấn kỹ thuật hoặc báo giá cho các sản phẩm ete công nghiệp?
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →










