Kiến thức chuyên môn
Chuẩn độ là gì? Khái niệm và vai trò trong phân tích hóa học
Trong lĩnh vực hóa học phân tích, việc xác định chính xác nồng độ mol của một chất là cực kỳ quan trọng. Một trong những kỹ thuật nền tảng và được sử dụng rộng rãi nhất để đạt được mục tiêu này chính là chuẩn độ. Vậy chuẩn độ là gì và làm thế nào để thực hiện nó một cách chính xác?
Bài viết này sẽ cung cấp một hướng dẫn chi tiết từ A-Z, giúp bạn nắm vững mọi khía cạnh của phương pháp này, từ nguyên tắc cơ bản, các loại phổ biến đến cách thực hiện và tính toán kết quả.
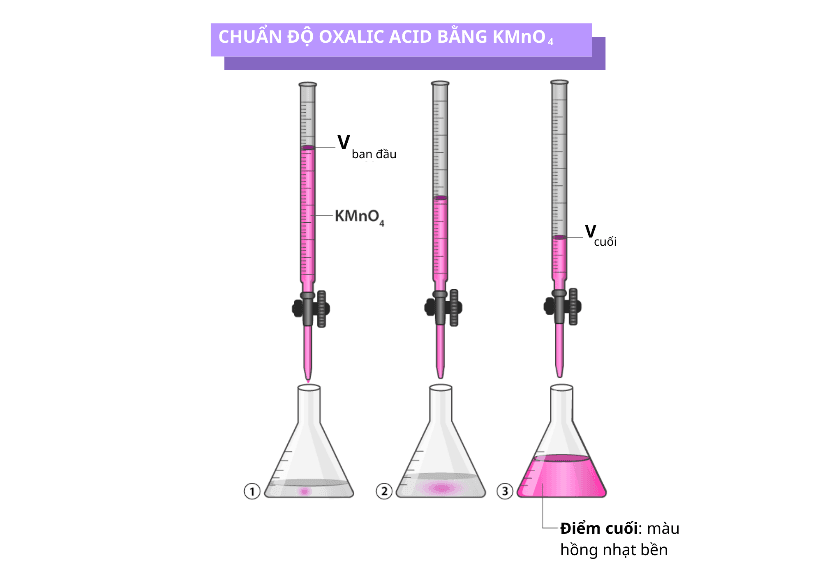
Nguyên Tắc Cốt Lõi Của Phương Pháp Chuẩn Độ
Chuẩn độ là phương pháp dùng một dung dịch đã biết nồng độ (dung dịch chuẩn) để xác định nồng độ của một dung dịch khác (chất phân tích) dựa trên phản ứng hóa học hoàn toàn giữa chúng, thường được nhận biết bằng sự đổi màu của chất chỉ thị tại điểm tương đương.
Chuẩn độ (Titration) là một phương pháp phân tích định lượng nhằm xác định nồng độ của một dung dịch chất phân tích (analyte) chưa biết, bằng cách cho nó phản ứng từ từ với một dung dịch đã biết nồng độ chính xác, gọi là dung dịch chuẩn (titrant).
Nguyên tắc của quá trình này dựa trên một phản ứng trung hòa hoặc phản ứng hóa học hoàn toàn giữa analyte và titrant. Dung dịch chuẩn được thêm vào từ buret cho đến khi phản ứng xảy ra hoàn toàn, thời điểm này được gọi là điểm tương đương.
Để một phản ứng được ứng dụng trong chuẩn độ, nó cần đáp ứng các điều kiện sau (cập nhật 2025):
- ✔ Phản ứng nhanh: Phản ứng phải xảy ra gần như tức thì.
- ✔ Hoàn toàn: Hiệu suất phản ứng phải đạt trên 99.9%.
- ✔ Tỷ lệ xác định: Tỷ lệ mol (hệ số tỉ lượng) giữa các chất phản ứng phải được biết rõ.
- ✔ Có dấu hiệu nhận biết: Phải có một sự thay đổi rõ rệt (màu sắc, pH, điện thế) tại điểm tương đương, thường được nhận biết thông qua chất chỉ thị.
Các Loại Chuẩn Độ Phổ Biến Nhất Hiện Nay
Bốn loại chuẩn độ chính bao gồm: Chuẩn độ Axit-Bazơ, Oxi hóa-Khử (Redox), Kết tủa, và Tạo phức (Complexometric). Mỗi loại dựa trên một bản chất phản ứng hóa học riêng biệt.
Dựa vào bản chất của phản ứng hóa học, chuẩn độ được chia thành bốn loại chính. Mỗi loại có ứng dụng riêng trong việc xác định các chất khác nhau.
Chuẩn độ Axit-Bazơ
Là phương pháp dựa trên phản ứng trung hòa giữa axit và bazơ, dùng để xác định nồng độ của chúng.
Đây là loại phổ biến nhất. Ví dụ kinh điển là xác định nồng độ của dung dịch Axit clohidric (HCl) bằng dung dịch Natri hidroxit (NaOH) đã biết nồng độ.
Chuẩn độ Oxi hóa-Khử (Redox)
Dựa trên phản ứng trao đổi electron giữa một chất oxi hóa và một chất khử.
Ví dụ: Chuẩn độ Iốt (I₂) bằng dung dịch Sodium thiosulfate (Na₂S₂O₃) với chất chỉ thị là hồ tinh bột.
Chuẩn độ Kết Tủa
Dựa trên sự hình thành một chất kết tủa không tan để xác định nồng độ ion.
Ví dụ: Chuẩn độ ion Clorua (Cl⁻) bằng dung dịch Bạc Nitrat (AgNO₃) tạo ra kết tủa Bạc Clorua (AgCl) màu trắng.
Chuẩn độ Tạo Phức (Complexometric)
Dựa trên phản ứng tạo thành một phức chất bền vững giữa ion kim loại và một tác nhân tạo phức, phổ biến nhất là EDTA.
Ứng dụng rộng rãi để xác định độ cứng của nước (hàm lượng Ca²⁺, Mg²⁺) và nồng độ các ion kim loại nặng.
Cấu trúc của một số phân tử thường gặp trong các phương pháp chuẩn độ:
Quy Trình Thực Hiện Chuẩn Độ Chi Tiết
Quy trình chuẩn độ gồm 7 bước: Chuẩn bị dụng cụ, Lấy mẫu chính xác, Thêm chất chỉ thị, Tiến hành chuẩn độ từ từ, Dừng lại ở điểm cuối, Ghi nhận kết quả, và Lặp lại để kiểm chứng.
- Chuẩn bị: Rửa sạch buret, pipette và bình tam giác bằng nước cất. Tráng buret bằng dung dịch chuẩn và tráng pipette bằng dung dịch cần phân tích.
- Lấy mẫu: Dùng pipette hút một thể tích chính xác của dung dịch analyte cho vào bình tam giác.
- Thêm chất chỉ thị: Thêm 2-3 giọt chất chỉ thị màu phù hợp. Ví dụ, Phenolphthalein cho chuẩn độ axit mạnh – bazơ mạnh.
- Tiến hành chuẩn độ: Mở khóa buret để dung dịch chuẩn chảy từ từ xuống, đồng thời lắc đều bình. Giảm tốc độ khi màu bắt đầu thay đổi.
- Kết thúc: Khóa buret ngay khi dung dịch chuyển sang màu bền vững (không mất màu sau khi lắc 30 giây). Đây chính là điểm cuối (endpoint).
- Ghi nhận kết quả: Đọc và ghi lại thể tích dung dịch chuẩn đã sử dụng trên buret.
- Lặp lại: Thực hiện lại thí nghiệm ít nhất 3 lần. Kết quả chính xác khi thể tích chênh lệch giữa các lần đo không quá 0.2 mL.
Công Thức Tính Toán Nồng Độ Trong Chuẩn Độ
Công thức chính là Ca × Va = (Ct × Vt) / n, trong đó C là nồng độ, V là thể tích của chất phân tích (a) và dung dịch chuẩn (t), và n là hệ số tỉ lượng.
Trong đó:
Ca: Nồng độ của chất phân tích (analyte) – cần tìm (đơn vị M).
Va: Thể tích của chất phân tích (đơn vị L).
Ct: Nồng độ của dung dịch chuẩn (titrant) – đã biết (đơn vị M).
Vt: Thể tích của dung dịch chuẩn đã sử dụng (đơn vị L).
n: Tỷ lệ mol giữa analyte và titrant theo phương trình phản ứng.
Các Lỗi Thường Gặp Và Cách Khắc Phục
Các lỗi phổ biến gồm đọc sai thể tích, chọn sai chất chỉ thị, chuẩn độ quá tay, và dụng cụ không sạch. Khắc phục bằng cách thực hành cẩn thận, đọc vạch mức chính xác, và chọn chỉ thị có dải pH phù hợp.
- Đọc sai thể tích trên buret: Luôn đọc thể tích ở điểm đáy của mặt cong chất lỏng (meniscus) và đảm bảo mắt bạn ngang tầm với vạch đọc.
- Lỗi điểm cuối (Endpoint Error): Chọn sai chất chỉ thị có thể dẫn đến điểm cuối xuất hiện trước hoặc sau điểm tương đương. Cần chọn chỉ thị có khoảng pH đổi màu trùng với pH tại điểm tương đương.
- Chuẩn độ quá tay (Overshooting): Nhỏ dung dịch chuẩn quá nhanh khi gần đến điểm cuối. Cần giảm tốc độ và thêm từng giọt một khi thấy dấu hiệu đổi màu.
- Dụng cụ không sạch: Dụng cụ bẩn có thể làm sai lệch nồng độ dung dịch, dẫn đến kết quả không chính xác.
Kết Luận
Chuẩn độ là một kỹ thuật phân tích mạnh mẽ, chính xác và tương đối dễ thực hiện. Bằng cách nắm vững nguyên tắc, phân loại và quy trình thực hiện, bạn có thể ứng dụng phương pháp này để xác định nồng độ của nhiều loại hóa chất khác nhau trong phòng thí nghiệm cũng như trong sản xuất công nghiệp.
Để đảm bảo thí nghiệm của bạn luôn thành công, việc sử dụng các hóa chất tinh khiết và dụng cụ đo lường chính xác là yếu tố không thể thiếu. Nếu bạn có nhu cầu mua hóa chất hoặc các thiết bị phòng thí nghiệm chất lượng, hãy tham khảo các sản phẩm tại Hóa chất Doanh Tín.





