Kiến thức chuyên môn
Đồng(II) Clorua (CuCl₂): Cấu Trúc, Tính Chất và Ứng Dụng Toàn Diện
Trong thế giới hóa học, Đồng(II) clorua, với công thức hóa học là CuCl₂, là một hợp chất vô cơ quan trọng và linh hoạt. Đây là muối được tạo thành từ cation đồng ở trạng thái oxy hóa +2 và hai anion clorua (Cl⁻). Hợp chất này không chỉ là một chủ đề hấp dẫn trong nghiên cứu khoa học mà còn có nhiều ứng dụng thực tiễn trong các ngành công nghiệp khác nhau. Bài viết này sẽ cung cấp một cái nhìn chi tiết và toàn diện về CuCl₂, từ tính chất vật lý, hóa học đến các phương pháp sản xuất và ứng dụng của nó.
Tính Chất Vật Lý và Hóa Học Của CuCl₂
Tính Chất Vật Lý
CuCl₂ tồn tại ở hai dạng chính, mỗi dạng có những đặc điểm riêng biệt:
- Dạng ngậm nước (CuCl₂·2H₂O): Là những tinh thể màu xanh lam sáng, có khả năng hòa tan tốt trong nước, tạo thành dung dịch màu xanh đặc trưng.
- Dạng khan (CuCl₂): Là bột màu nâu, hút ẩm mạnh và ít tan hơn so với dạng ngậm nước.
- Khối lượng mol: Dạng khan có khối lượng mol là 134,45 g/mol, trong khi dạng ngậm nước là 170,48 g/mol.
- Độ tan: CuCl₂ tan tốt trong các dung môi phân cực như nước, ethanol, và acetone, nhưng ít tan trong các dung môi không phân cực.
Tính Chất Hóa Học
Đồng(II) clorua là một chất oxy hóa mạnh và tham gia vào nhiều phản ứng hóa học quan trọng:
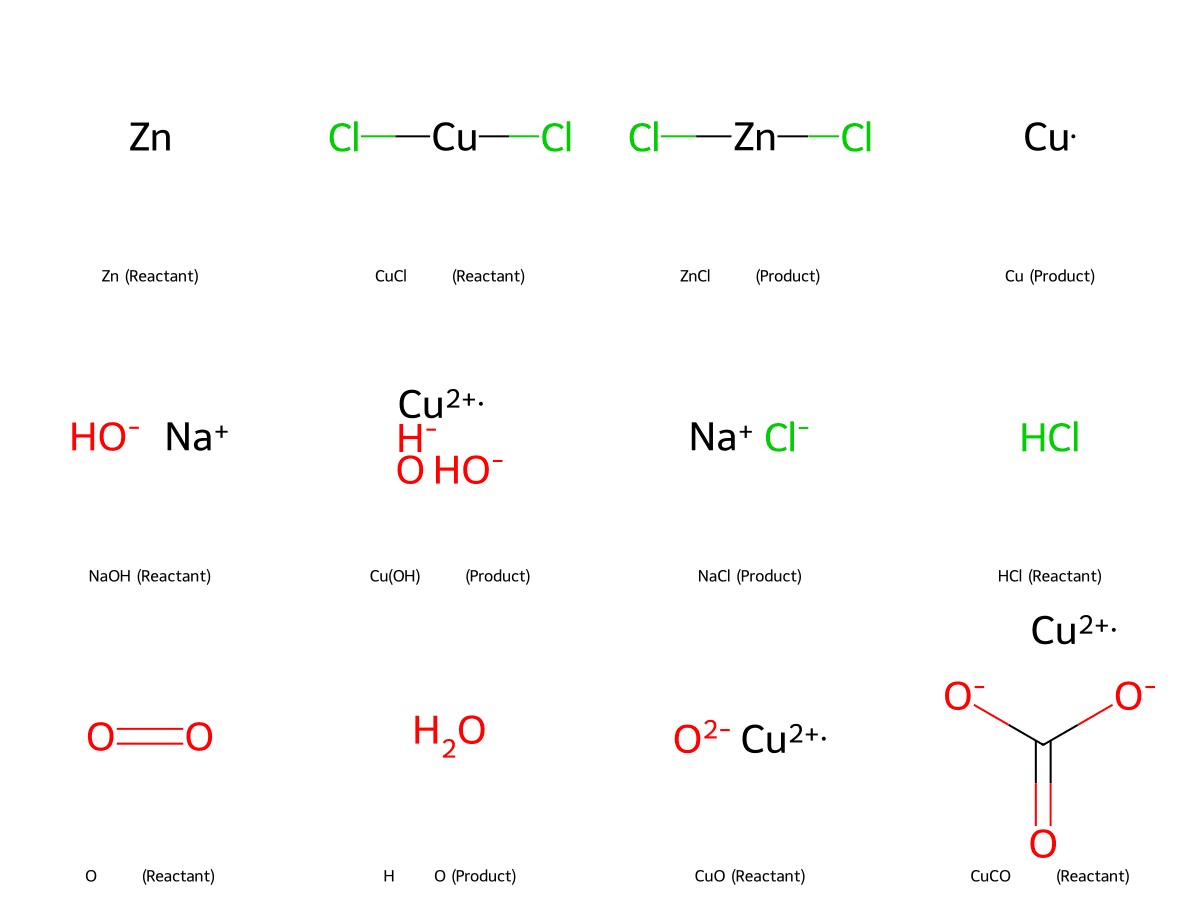
- Phản ứng với kim loại: CuCl₂ có khả năng phản ứng với các kim loại hoạt động mạnh hơn đồng như kẽm (Zn) hoặc sắt (Fe), tạo ra muối của kim loại đó và giải phóng đồng kim loại. Đây là một ví dụ điển hình của phản ứng thế.
Phương trình phản ứng: Zn + CuCl₂ ⟶ ZnCl₂ + Cu
- Phản ứng với kiềm: Khi tác dụng với dung dịch kiềm mạnh như Natri hydroxit (NaOH), CuCl₂ tạo ra kết tủa đồng(II) hydroxit (Cu(OH)₂) màu xanh lơ.
Phương trình phản ứng: CuCl₂ + 2NaOH ⟶ Cu(OH)₂↓ + 2NaCl
- Phản ứng tạo phức: Ion Cu²⁺ trong CuCl₂ có khả năng tạo phức với nhiều phối tử khác nhau. Ví dụ, khi tác dụng với dung dịch amoniac (NH₃), nó tạo thành phức chất tetraamminecopper(II) [Cu(NH₃)₄]²⁺, có màu xanh đậm đặc trưng.
Phương Pháp Sản Xuất và Điều Chế CuCl₂
CuCl₂ được điều chế chủ yếu bằng cách cho đồng kim loại, đồng(II) oxit, hoặc đồng(II) cacbonat phản ứng với axit clohydric (HCl), thường có sự hiện diện của chất oxy hóa.
Trong công nghiệp và phòng thí nghiệm, CuCl₂ có thể được sản xuất bằng nhiều phương pháp khác nhau:
- Phản ứng của đồng với axit clohydric: Đồng kim loại (Cu) có thể phản ứng trực tiếp với axit clohydric (HCl) với sự có mặt của oxy hoặc các chất oxy hóa khác như hydro peroxide (H₂O₂).
Phương trình phản ứng: 2Cu + 4HCl + O₂ ⟶ 2CuCl₂ + 2H₂O
- Phản ứng của oxit hoặc cacbonat đồng với axit clohydric: Các hợp chất của đồng như đồng(II) oxit (CuO) hoặc đồng(II) cacbonat (CuCO₃) cũng phản ứng dễ dàng với HCl để tạo ra CuCl₂.
CuO + 2HCl ⟶ CuCl₂ + H₂O
CuCO₃ + 2HCl ⟶ CuCl₂ + CO₂ + H₂O - Tinh thể hóa: Sau khi điều chế, dung dịch CuCl₂ được làm bay hơi nước để thu được các tinh thể ngậm nước CuCl₂·2H₂O.
Ứng Dụng Thực Tiễn Của CuCl₂
CuCl₂ được ứng dụng rộng rãi làm chất xúc tác trong tổng hợp hữu cơ, xử lý bề mặt kim loại, tạo màu cho gốm sứ, và là thành phần trong một số loại thuốc trừ nấm nông nghiệp.
Đồng(II) clorua có một loạt các ứng dụng quan trọng trong nhiều lĩnh vực:
- Công nghiệp:
- Được sử dụng làm chất xúc tác trong nhiều quy trình tổng hợp hữu cơ, đặc biệt là trong sản xuất vinyl clorua, một tiền chất quan trọng để sản xuất nhựa PVC (Poli(vinyl clorua)).
- Ứng dụng trong ngành luyện kim để xử lý bề mặt kim loại.
- Được sử dụng làm chất tạo màu cho thủy tinh và gốm sứ.
- Phòng thí nghiệm:
- Là một thuốc thử phổ biến trong các thí nghiệm hóa học, đặc biệt là trong các phản ứng oxy hóa-khử.
- Được sử dụng để điều chế các hợp chất đồng khác.
- Nông nghiệp:
- CuCl₂ là một thành phần trong một số loại thuốc trừ nấm, giúp bảo vệ cây trồng khỏi các bệnh do nấm gây ra.
- Giáo dục:
- Được sử dụng trong các thí nghiệm giảng dạy để minh họa các khái niệm về phản ứng hóa học, chẳng hạn như phản ứng tạo kết tủa hoặc tạo phức chất.
Những Lưu Ý Quan Trọng Khi Sử Dụng CuCl₂
Mặc dù có nhiều ứng dụng hữu ích, việc sử dụng CuCl₂ đòi hỏi phải tuân thủ các quy tắc an toàn nghiêm ngặt:
- An toàn: CuCl₂ có tính ăn mòn và độc hại nếu nuốt phải hoặc tiếp xúc trực tiếp với da trong thời gian dài. Do đó, cần phải trang bị đầy đủ đồ bảo hộ cá nhân như găng tay, kính bảo hộ khi làm việc với hóa chất này.
- Bảo quản: Nên bảo quản hóa chất này trong các thùng chứa kín, đặt ở nơi khô ráo, thoáng mát để ngăn chặn sự hút ẩm và biến đổi giữa dạng khan và dạng ngậm nước.
- Xử lý chất thải: Không được đổ trực tiếp ra môi trường. Chất thải chứa CuCl₂ cần được xử lý theo các quy định về quản lý chất thải nguy hại để tránh gây ô nhiễm môi trường.
Câu Hỏi Thường Gặp
Hỏi: CuCl₂ có độc không?
Có, CuCl₂ là một hóa chất độc. Việc nuốt phải hoặc tiếp xúc lâu dài có thể gây hại cho sức khỏe. Luôn tuân thủ các biện pháp an toàn khi sử dụng.
Hỏi: Tại sao dung dịch CuCl₂ lại có màu xanh?
Màu xanh của dung dịch CuCl₂ là do sự hình thành của phức chất aqua [Cu(H₂O)₆]²⁺. Phức chất này hấp thụ ánh sáng ở vùng màu đỏ của quang phổ và phản xạ lại ánh sáng màu xanh, tạo ra màu sắc mà chúng ta quan sát được.
Hỏi: CuCl₂ có phải là muối ăn không?
Không, tuyệt đối không. Muối ăn là Natri clorua (NaCl), một hợp chất an toàn cho con người. Ngược lại, CuCl₂ là một hóa chất độc và không được sử dụng trong thực phẩm.
Tóm lại, Đồng(II) clorua (CuCl₂) là một hợp chất hóa học đa năng với nhiều ứng dụng quan trọng trong các ngành công nghiệp và nghiên cứu. Tuy nhiên, do độc tính của nó, việc sử dụng và xử lý CuCl₂ cần được thực hiện một cách cẩn trọng và tuân thủ nghiêm ngặt các quy định về an toàn hóa chất.





