Kiến thức chuyên môn
Khí Trơ Là Gì? Phân Loại, Ứng Dụng & Tiêu Chuẩn An Toàn
Trong ngành công nghiệp hiện đại, từ sản xuất vi mạch điện tử đến hàn các kết cấu siêu trọng, việc tạo ra một môi trường phản ứng được kiểm soát tuyệt đối là yếu tố sống còn. Đó là lúc khí trơ phát huy vai trò không thể thiếu của mình. Nhưng khí trơ là gì mà lại có khả năng đặc biệt đến vậy?
Nhiều doanh nghiệp chỉ dừng lại ở việc biết tên chúng – Heli, Argon, Neon… – mà chưa thực sự hiểu sâu về bản chất, cách lựa chọn độ tinh khiết phù hợp hay các tiêu chuẩn an toàn đi kèm.
Với kinh nghiệm 20 năm trong ngành hóa chất công nghiệp, Hóa Chất Doanh Tín sẽ cung cấp một góc nhìn chuyên sâu, giúp bạn không chỉ hiểu đúng mà còn ứng dụng hiệu quả, an toàn các loại khí đặc biệt này.
1. Khí Trơ Được Giải Mã Như Thế Nào Và Tại Sao Chúng Không Chỉ “Không Phản Ứng”?
Khí trơ, hay khí hiếm, được định nghĩa là các nguyên tố hóa học thuộc nhóm 18 của bảng tuần hoàn, đặc trưng bởi tính trơ do cấu trúc electron bão hòa, khiến chúng gần như không tham gia vào các phản ứng hóa học thông thường.
Khí trơ, hay còn gọi là khí hiếm, là tập hợp các nguyên tố hóa học thuộc nhóm 18 trong bảng tuần hoàn. Tên gọi “trơ” (inert) xuất phát từ đặc tính nổi bật nhất của chúng: hầu như không tham gia vào các phản ứng hóa học trong điều kiện thông thường.
Tại Sao Khí Trơ Lại Được Coi Là “Trơ” Và Bí Mật Đằng Sau Là Gì?
Tính trơ của các khí này bắt nguồn từ cấu trúc nguyên tử có lớp electron ngoài cùng đã bão hòa hoàn toàn, tạo ra một cấu hình cực kỳ bền vững và không có xu hướng trao đổi electron.
Nguyên nhân sâu xa nằm ở cấu trúc nguyên tử. Lớp electron ngoài cùng của các khí trơ đều đã bão hòa (với 8 electron, riêng Heli là 2), đây là cấu hình bền vững nhất. Chúng không có xu hướng nhận, cho, hay góp chung electron để tạo thành liên kết ion hay liên kết cộng hóa trị.
Điều này tạo nên một “lớp áo giáp” hóa học hoàn hảo, khiến chúng trở thành tác nhân bảo vệ lý tưởng trong vô số quy trình công nghiệp.
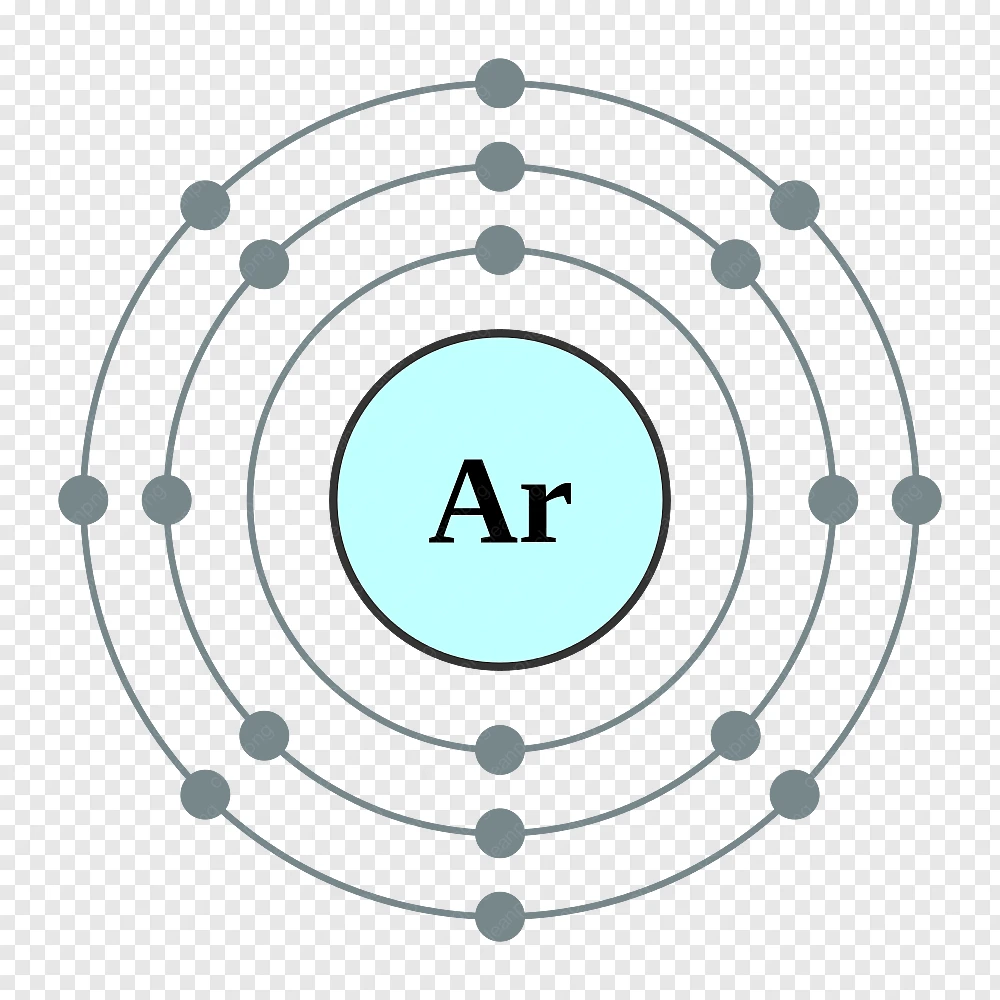
Liệu Khí “Hiếm” Có Thực Sự Hiếm Như Tên Gọi?
Không hoàn toàn. Tên gọi “khí hiếm” có thể gây hiểu lầm vì một số loại khí trơ như Argon khá phổ biến trong khí quyển, nhưng quá trình tách chiết và tinh lọc chúng lại phức tạp và tốn kém.
Tên gọi “khí hiếm” (noble gas) có thể gây hiểu lầm. Thực tế, một số loại khí trơ khá phổ biến. Ví dụ, Argon (Ar) chiếm gần 1% thể tích khí quyển Trái Đất, nhiều hơn cả Carbon Dioxide (CO2).
Tuy nhiên, quá trình chưng cất và tinh lọc chúng từ không khí lỏng đòi hỏi công nghệ phức tạp và tốn kém, khiến chúng trở nên “quý giá” và có giá trị thương mại cao.
2. Các Loại Khí Trơ Phổ Biến và Tính Chất Đặc Trưng Của Chúng Là Gì?
Mỗi khí trơ trong nhóm 18, bao gồm Heli, Neon, Argon, Krypton, Xenon và Radon, đều có các tính chất vật lý riêng biệt như khối lượng, điểm sôi và khả năng phát sáng, quyết định các ứng dụng chuyên biệt của chúng.
Mỗi khí trơ trong nhóm 18, dù chung đặc tính trơ, lại sở hữu những tính chất vật lý riêng biệt, quyết định đến ứng dụng độc đáo của chúng.
| Nguyên Tố | Ký Hiệu | Số Nguyên Tử | Đặc Tính Nổi Bật |
|---|---|---|---|
| Heli | He | 2 | Cực nhẹ, dẫn nhiệt tốt, nhiệt độ sôi thấp nhất |
| Neon | Ne | 10 | Phát sáng màu đỏ cam đặc trưng khi có dòng điện |
| Argon | Ar | 18 | Phổ biến nhất, giá thành hợp lý, trơ ở nhiệt độ cao |
| Krypton | Kr | 36 | Sáng hơn Argon, hiệu suất chiếu sáng cao |
| Xenon | Xe | 54 | Rất nặng, gây mê, phát ra ánh sáng trắng xanh mạnh |
| Radon | Rn | 86 | Phóng xạ, nặng nhất |
Góc nhìn chuyên gia – Nguyễn Thị Mỹ Linh:
“Khi lựa chọn khí trơ, đừng chỉ nhìn vào giá mỗi bình. Hãy xem xét tổng chi phí sở hữu (Total Cost of Ownership). Ví dụ, Krypton đắt hơn Argon, nhưng dùng nó trong sản xuất bóng đèn kính hai lớp có thể tăng hiệu quả cách nhiệt, giúp sản phẩm cuối cùng tiết kiệm năng lượng hơn, tạo ra lợi thế cạnh tranh lớn trên thị trường.”
3. Vai trò sống còn của khí trơ trong công nghiệp là gì?
Trong công nghiệp, khí trơ đóng vai trò sống còn trong việc tạo ra môi trường bảo vệ, ngăn chặn các phản ứng không mong muốn như oxy hóa trong các quy trình như hàn kim loại, sản xuất bán dẫn, làm lạnh siêu dẫn và chiếu sáng công nghệ cao.
Từ định nghĩa học thuật, hãy cùng đi vào các ứng dụng thực tiễn mà khí trơ đang đóng góp cho nền sản xuất Việt Nam.
Argon (Ar) được mệnh danh là “Người Hùng Thầm Lặng” của ngành luyện kim và chế tạo vì sao?
Argon là khí trơ được sử dụng rộng rãi nhất, đóng vai trò tạo môi trường bảo vệ không thể thiếu trong hàn & cắt kim loại (MIG, TIG), sản xuất bóng đèn và công nghiệp bán dẫn, đảm bảo chất lượng và độ bền cho sản phẩm.
Đây là loại khí trơ được sử dụng rộng rãi nhất.
- Hàn & Cắt kim loại (MIG, TIG): Argon tạo ra một môi trường khí quyển bảo vệ xung quanh hồ quang và vũng hàn nóng chảy, ngăn chặn quá trình oxy hóa từ không khí. Điều này đặc biệt quan trọng khi hàn các kim loại phản ứng mạnh như nhôm, titan, và thép không gỉ, đảm bảo mối hàn sạch, bền và không bị rỗ.
- Sản xuất bóng đèn: Argon được bơm vào bóng đèn sợi đốt để ngăn dây tóc vonfram bị oxy hóa và bay hơi ở nhiệt độ cao, đây là một trong những ứng dụng thú vị của hóa học với đời sống.
- Công nghiệp bán dẫn: Một môi trường Argon siêu tinh khiết là bắt buộc trong quá trình nuôi cấy tinh thể silicon và gecmani.
Case Study từ Doanh Tín:
Một xưởng gia công cơ khí chính xác tại Bình Dương đã gặp vấn đề mối hàn nhôm bị đen và yếu. Sau khi đội ngũ kỹ thuật của Doanh Tín khảo sát, chúng tôi phát hiện họ đang dùng Argon 4.8 không đủ tinh khiết. Bằng cách chuyển sang Argon 5.2 của chúng tôi và hiệu chỉnh lưu lượng khí, tỷ lệ sản phẩm lỗi của họ đã giảm từ 15% xuống dưới 1%, tiết kiệm hàng trăm triệu đồng mỗi năm.
Heli (He) có những ứng dụng đặc biệt nào nhờ đặc tính nhẹ và lạnh sâu?
Nhờ đặc tính siêu nhẹ và điểm sôi cực thấp, Heli không thể thay thế trong việc làm lạnh nam châm siêu dẫn của máy MRI, làm khí mang trong sắc ký khí, và là thành phần trong bình dưỡng khí cho thợ lặn sâu.
Với đặc tính siêu nhẹ và điểm sôi cực thấp (-269°C), Heli có những ứng dụng không thể thay thế.
- Làm lạnh siêu dẫn: Heli lỏng là chất duy nhất đủ lạnh để làm mát các nam châm siêu dẫn trong máy chụp cộng hưởng từ (MRI) tại các bệnh viện lớn ở TP.HCM và Hà Nội.
- Khí mang trong sắc ký khí (GC): Do tính trơ và độ dẫn nhiệt cao, Heli là khí mang lý tưởng để phân tích các mẫu hóa học.
- Bình dưỡng khí cho thợ lặn: Hỗn hợp Heliox (Heli và Oxy) được sử dụng cho các công ty dịch vụ lặn biển chuyên nghiệp tại Vũng Tàu, Nha Trang.
Ứng dụng của Neon (Ne), Krypton (Kr), Xenon (Xe) trong chiếu sáng và công nghệ cao là gì?
Nhóm khí trơ này chủ yếu được ứng dụng trong lĩnh vực chiếu sáng hiệu suất cao (đèn quảng cáo, đèn pha ô tô, đèn sân bay) và trong các công nghệ tiên tiến như động cơ đẩy ion cho tàu vũ trụ.
Nhóm khí trơ này nổi bật trong lĩnh vực chiếu sáng và quang học.
- Neon (Ne): Tạo ra ánh sáng màu đỏ cam đặc trưng trong các biển quảng cáo, đèn báo hiệu điện thế cao.
- Krypton (Kr) & Xenon (Xe): Được sử dụng trong các loại đèn hiệu suất cao như đèn pha ô tô, đèn flash máy ảnh, và đèn cho đường băng sân bay. Chúng cho ánh sáng trắng và sáng hơn Argon, giúp tiết kiệm năng lượng.
- Động cơ đẩy ion: Xenon đang được NASA và các cơ quan không gian sử dụng làm nhiên liệu cho động cơ đẩy ion trên các tàu vũ trụ và vệ tinh, mang lại hiệu quả cao cho các nhiệm vụ dài ngày. Dữ liệu mới nhất cho thấy các nhiệm vụ như Starlink của SpaceX tiếp tục phụ thuộc rất nhiều vào động cơ đẩy Hall sử dụng Xenon, khẳng định vai trò của nó trong ngành hàng không vũ trụ năm 2025.
4. Tại sao độ tinh khiết lại là chìa khóa khi lựa chọn khí trơ?
Độ tinh khiết là yếu tố quyết định chất lượng và sự thành công của quy trình ứng dụng. Sử dụng sai độ tinh khiết có thể gây ra các lỗi nghiêm trọng như mối hàn yếu, nhiễm bẩn sản phẩm bán dẫn, hoặc sai lệch kết quả phân tích.
Trong môi trường công nghiệp, “Argon” không chỉ đơn giản là Argon. Chất lượng của nó được quyết định bởi độ tinh khiết.
Các cấp độ tinh khiết của Argon và ứng dụng tương ứng là gì?
Argon được phân loại theo các cấp độ tinh khiết (ví dụ: 4.8, 5.0, 6.0), mỗi cấp độ phù hợp với các ứng dụng cụ thể từ hàn công nghiệp thông thường đến sản xuất vi mạch điện tử siêu sạch.
| Cấp Độ Tinh Khiết | Tên Thường Gọi | Tỷ Lệ Tinh Khiết | Ứng Dụng Phù Hợp |
|---|---|---|---|
| Argon 4.8 | Argon Công Nghiệp | 99.998% | Hàn MIG/TIG thép carbon, cắt plasma. |
| Argon 5.0 | Argon Tinh Khiết | 99.999% | Hàn nhôm, thép không gỉ, hợp kim đặc biệt. |
| Argon 5.2 | Argon Cao Cấp | 99.9992% | Hàn laser, ứng dụng đòi hỏi mối hàn siêu sạch. |
| Argon 6.0 | Argon Siêu Tinh Khiết | 99.9999% | Sản xuất bán dẫn, nghiên cứu, phân tích thí nghiệm. |
Tải về tài liệu kỹ thuật:
Bạn cần thông số chi tiết và hướng dẫn an toàn cho khí Argon?
5. Những nguyên tắc vàng về an toàn khi sử dụng khí trơ là gì?
Nguyên tắc an toàn quan trọng nhất bao gồm đảm bảo thông gió đầy đủ để tránh nguy cơ ngạt thở, và tuân thủ nghiêm ngặt các quy định về xử lý bình khí nén áp suất cao và khí hóa lỏng nhiệt độ cực thấp theo tiêu chuẩn TCVN.
Mặc dù không độc hại, khí trơ vẫn tiềm ẩn những rủi ro vật lý cần được quản lý chặt chẽ, tuân thủ theo quy định của Việt Nam.
Tại sao nguy cơ ngạt thở lại là rủi ro chính?
Nguy cơ ngạt thở xảy ra do khí trơ (thường nặng hơn không khí) có thể tích tụ trong không gian kín, chiếm chỗ của oxy mà không có dấu hiệu cảnh báo như màu hay mùi, dẫn đến tình trạng thiếu oxy đột ngột.
Khí trơ nặng hơn không khí (trừ Heli) có thể tích tụ trong không gian kín, đẩy Oxy ra ngoài và gây ngạt mà không có dấu hiệu cảnh báo (tìm hiểu thêm về ghi nhãn hóa chất theo GHS). Luôn đảm bảo khu vực làm việc thông thoáng và sử dụng thiết bị giám sát nồng độ Oxy khi cần thiết.
Cần xử lý rủi ro từ áp suất cao và nhiệt độ thấp như thế nào?
Rủi ro này cần được xử lý bằng cách tuân thủ TCVN 6292:2007 cho việc lưu trữ và vận chuyển bình khí nén, đồng thời sử dụng đầy đủ đồ bảo hộ cá nhân chuyên dụng để tránh bỏng lạnh khi tiếp xúc với khí hóa lỏng.
- Bình khí nén: Phải được lưu trữ, vận chuyển và sử dụng theo TCVN 6292:2007 và các quy chuẩn liên quan. Tránh va đập mạnh, để xa nguồn nhiệt.
- Khí hóa lỏng (Cryogenic): Tiếp xúc trực tiếp với Heli lỏng hoặc Argon lỏng có thể gây bỏng lạnh nghiêm trọng. Bắt buộc phải sử dụng đầy đủ đồ bảo hộ cá nhân (găng tay, kính, mặt nạ).
6. Những câu hỏi thường gặp về khí trơ là gì?
Các câu hỏi phổ biến nhất bao gồm sự khác biệt giữa “khí trơ” và “khí hiếm”, cách kiểm tra độ tinh khiết, và khả năng cung cấp khí ở dạng lỏng của các nhà cung cấp.
-
Q1: Khí trơ và khí hiếm có phải là một?
A: Về cơ bản là có. “Khí hiếm” là tên gọi các nguyên tố nhóm 18, còn “khí trơ” mô tả đặc tính hóa học nổi bật của các chất khí này.
-
Q2: Làm thế nào để kiểm tra độ tinh khiết của khí?
A: Độ tinh khiết được nhà cung cấp uy tín chứng nhận qua Certificate of Analysis (COA). Đối với các ứng dụng cực kỳ nhạy cảm, có thể sử dụng máy sắc ký khí tại chỗ để kiểm tra.
-
Q3: Hóa Chất Doanh Tín có cung cấp khí trơ dạng lỏng không?
A: Có, chúng tôi cung cấp Argon và Heli dạng lỏng trong các bình chứa chuyên dụng (dewar) cho các khách hàng có nhu cầu sử dụng lớn.
7. Tại sao nên chọn Hóa Chất Doanh Tín làm nhà cung cấp giải pháp khí trơ toàn diện?
Bởi vì chúng tôi không chỉ cung cấp sản phẩm đạt chuẩn với đầy đủ chứng nhận, mà còn mang đến giải pháp toàn diện bao gồm tư vấn kỹ thuật chuyên sâu, hệ thống logistics đáng tin cậy và hỗ trợ khách hàng 24/7.
Hiểu rõ khí trơ là gì chỉ là bước đầu tiên. Để tối ưu hóa quy trình sản xuất, bạn cần một đối tác có thể cung cấp sản phẩm đúng độ tinh khiết, tư vấn giải pháp phù hợp và đảm bảo nguồn cung ổn định, an toàn. Hãy khám phá các giải pháp hóa chất công nghiệp của chúng tôi.
Cam kết của chúng tôi:
✅ Sản phẩm đạt chuẩn: Cung cấp đầy đủ Giấy chứng nhận Phân tích (COA).
✅ Giao hàng đúng hẹn: Hệ thống logistics chuyên nghiệp trên toàn quốc.
✅ Hỗ trợ kỹ thuật 24/7: Giải đáp mọi thắc mắc về sản phẩm và ứng dụng.
Tuyên bố miễn trừ trách nhiệm: Thông tin trong bài viết chỉ mang tính chất tham khảo. Người sử dụng phải luôn tuân thủ các quy trình an toàn kỹ thuật tại cơ sở và tham khảo tài liệu MSDS đi kèm sản phẩm.





