Kiến thức chuyên môn
Chất kết tủa là gì? Phản ứng, dấu hiệu và ứng dụng thực tiễn
Trong hóa học, thuật ngữ “chất kết tủa” xuất hiện rất thường xuyên trong các phản ứng dung dịch. Hiểu rõ về hiện tượng này không chỉ là kiến thức nền tảng mà còn có ý nghĩa quan trọng trong nhiều ứng dụng thực tiễn. Bài viết này sẽ cung cấp một cái nhìn chi tiết và toàn diện nhất về chất kết tủa, từ định nghĩa, cơ chế hình thành, cách nhận biết đến các ứng dụng không thể bỏ qua trong năm 2025.

Định Nghĩa Chi Tiết Về Chất Kết Tủa
Chất kết tủa là sản phẩm ở thể rắn, không hòa tan, được tạo thành bên trong một dung dịch lỏng sau khi diễn ra một phản ứng hóa học. Chất rắn này thường lắng xuống đáy bình chứa do có khối lượng riêng lớn hơn dung môi.
Sự hình thành kết tủa là một dấu hiệu rõ ràng cho thấy các ion (các cation và anion) trong dung dịch đã tương tác và kết hợp với nhau để tạo thành một hợp chất mới có độ tan rất thấp.
- Phân biệt: Cần phân biệt chất kết tủa với chất tan. Chất tan có thể hòa tan hoàn toàn trong dung môi để tạo thành dung dịch đồng nhất (ví dụ: muối ăn NaCl trong nước), trong khi chất kết tủa tồn tại ở dạng rắn riêng biệt.
- Phân loại: Kết tủa có thể ở dạng tinh thể (kích thước hạt lớn, dễ lắng) hoặc dạng keo (hạt rất nhỏ, lơ lửng trong dung dịch).
Cơ Chế Và Điều Kiện Hình Thành Kết Tủa
Kết tủa hình thành khi tích nồng độ của các ion tham gia phản ứng (Q) trong dung dịch vượt quá một giá trị giới hạn được gọi là tích số tan (Ksp). Điều kiện cốt lõi để tạo kết tủa là Q > Ksp.
Kết tủa không tự nhiên xuất hiện mà được hình thành dựa trên các nguyên tắc hóa học cụ thể. Quá trình này xảy ra khi nồng độ của các ion trong dung dịch vượt qua một ngưỡng giới hạn gọi là tích số tan (Ksp).
Điều kiện tiên quyết: Nồng độ các ion phải đủ lớn để tích số nồng độ của chúng (Q) lớn hơn tích số tan (Ksp) của hợp chất đó.
- Nếu Q > Ksp: Phản ứng tạo kết tủa sẽ xảy ra cho đến khi Q = Ksp (trạng thái cân bằng bão hòa).
- Nếu Q ≤ Ksp: Dung dịch chưa bão hòa hoặc đã bão hòa, không có kết tủa mới được hình thành.
Ví dụ kinh điển: Khi trộn dung dịch Bạc Nitrat (AgNO₃) và Natri Clorua (NaCl), ion Ag⁺ và Cl⁻ sẽ kết hợp tạo thành Bạc Clorua (AgCl), một chất rắn màu trắng không tan.
Phương trình ion: Ag⁺(aq) + Cl⁻(aq) ⟶ AgCl(s)↓
Các yếu tố chính ảnh hưởng đến sự hình thành kết tủa:
- Nhiệt độ: Nhiệt năng thường làm tăng độ tan của chất rắn. Do đó, việc hạ nhiệt độ có thể thúc đẩy quá trình kết tủa và tăng hiệu suất thu hồi.
- Độ pH của dung dịch: pH ảnh hưởng đến nồng độ của các ion, đặc biệt là OH⁻ và H⁺. Ví dụ, kết tủa của các hidroxit kim loại như Cu(OH)₂ phụ thuộc rất nhiều vào độ pH. Bạn có thể tham khảo 4 công thức tính pH để hiểu rõ hơn.
- Tốc độ trộn và khuấy: Trộn quá nhanh có thể tạo ra các hạt kết tủa dạng keo, khó lắng và khó lọc. Khuấy nhẹ và đều giúp tạo ra các tinh thể lớn hơn.
Hướng Dẫn Cách Nhận Biết Chất Kết Tủa
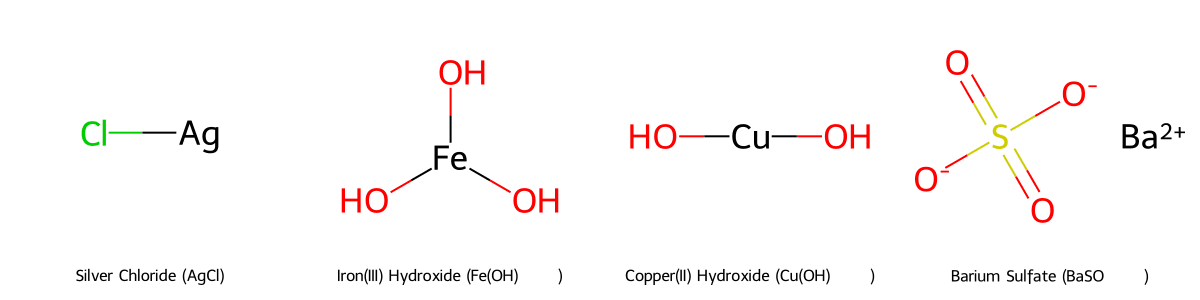
Có hai cách chính để nhận biết chất kết tủa: quan sát màu sắc đặc trưng của chất rắn (ví dụ AgCl màu trắng, Fe(OH)₃ màu đỏ nâu) và sử dụng Bảng tính tan để dự đoán hợp chất có tan trong dung môi hay không.
Việc xác định sự có mặt của kết tủa là một kỹ năng cơ bản trong phòng thí nghiệm. Có hai phương pháp chính để nhận biết:
Quan sát màu sắc đặc trưng
Nhận biết kết tủa bằng cách quan sát màu sắc của chất rắn được tạo thành. Mỗi kết tủa có một màu riêng biệt, đây là dấu hiệu trực quan nhanh chóng và phổ biến nhất trong phòng thí nghiệm.
Mỗi chất kết tủa thường có một màu sắc riêng biệt, đây là dấu hiệu nhận biết trực quan và nhanh chóng nhất. Để thuận tiện, bạn có thể tham khảo bảng màu một số kết tủa phổ biến dưới đây, số liệu cập nhật mới nhất cho năm 2025.
| Chất kết tủa | Công thức hóa học | Màu sắc | Ví dụ Phản ứng |
|---|---|---|---|
| Bạc Clorua | AgCl | Trắng | AgNO₃ + NaCl ⟶ AgCl↓ + NaNO₃ |
| Sắt(III) Hidroxit | Fe(OH)₃ | Đỏ nâu | FeCl₃ + 3NaOH ⟶ Fe(OH)₃↓ + 3NaCl |
| Đồng(II) Hidroxit | Cu(OH)₂ | Xanh lam | CuSO₄ + 2NaOH ⟶ Cu(OH)₂↓ + Na₂SO₄ |
| Bari Sunfat | BaSO₄ | Trắng | BaCl₂ + Na₂SO₄ ⟶ BaSO₄↓ + 2NaCl |
| Chì(II) Iodua | PbI₂ | Vàng tươi | Pb(NO₃)₂ + 2KI ⟶ PbI₂↓ + 2KNO₃ |
Sử dụng Bảng Tính Tan
Đây là phương pháp khoa học và chính xác để dự đoán sự hình thành kết tủa. Bằng cách tra cứu Bảng tính tan, ta có thể xác định được hợp chất nào là không tan hoặc ít tan trong dung môi.
Cách chính xác nhất để dự đoán một sản phẩm có phải là chất kết tủa hay không là tra cứu Bảng tính tan. Bảng này cung cấp thông tin chi tiết về độ tan của hàng trăm muối, axit và bazơ trong nước, giúp xác định nhanh chóng các hợp chất không tan hoặc ít tan.
Một số quy tắc chung cần nhớ:
- Hầu hết muối chứa ion nitrat (NO₃⁻) và amoni (NH₄⁺) đều tan.
- Hầu hết muối chứa ion kim loại kiềm (Li⁺, Na⁺, K⁺) đều tan.
- Hầu hết muối clorua (Cl⁻) đều tan, ngoại trừ AgCl, PbCl₂, Hg₂Cl₂.
Công Thức Tính Khối Lượng Kết Tủa
Khối lượng chất kết tủa được tính bằng công thức toán học cơ bản: m = n × M. Trong đó ‘m’ là khối lượng (đơn vị gam), ‘n’ là số mol của chất kết tủa, và ‘M’ là khối lượng mol phân tử (đơn vị g/mol).
Trong các bài toán hóa học, việc tính toán khối lượng chất kết tủa thu được là rất quan trọng để xác định hiệu suất phản ứng. Công thức được áp dụng như sau:
Trong đó:
- m: Khối lượng chất kết tủa (gam).
- n: Số mol chất kết tủa (mol).
- M: Khối lượng mol phân tử của chất kết tủa (g/mol).
Ví dụ thực tế: Cho 100ml dung dịch AgNO₃ 1M tác dụng hoàn toàn với dung dịch NaCl dư. Tính khối lượng AgCl thu được.
- Tính số mol AgNO₃: n = Cм × V = 1 × 0.1 = 0.1 mol.
- Phương trình phản ứng: AgNO₃ + NaCl ⟶ AgCl↓ + NaNO₃
- Tỷ lệ mol: Theo phương trình, 1 mol AgNO₃ tạo ra 1 mol AgCl. Vậy n_AgCl = n_AgNO₃ = 0.1 mol.
- Tính khối lượng AgCl: Khối lượng mol của AgCl là M_AgCl = 107.87 + 35.45 ≈ 143.32 g/mol.
Suy ra, m_AgCl = 0.1 × 143.32 = 14.332 g.
*Lưu ý: Công thức này giả định hiệu suất phản ứng là 100%. Trong thực tế, hiệu suất có thể thấp hơn và cần được tính toán cụ thể.
Ứng Dụng Thực Tế Của Phản Ứng Tạo Kết Tủa
Phản ứng tạo kết tủa được ứng dụng rộng rãi trong phân tích hóa học định tính, xử lý nước thải (sử dụng các chất keo tụ như phèn nhôm, PAC), sản xuất công nghiệp để tách và tinh chế kim loại, và sản xuất chất màu (pigment).
Phản ứng tạo kết tủa có vai trò vô cùng quan trọng và là nền tảng cho nhiều quy trình trong các lĩnh vực khác nhau:
- Phân tích hóa học: Dùng để xác định sự hiện diện của các ion trong dung dịch (phân tích định tính). Ví dụ, dùng dung dịch BaCl₂ để nhận biết sự có mặt của ion sunfat (SO₄²⁻) thông qua kết tủa trắng BaSO₄.
- Xử lý nước thải: Các chất keo tụ như phèn nhôm (Al₂(SO₄)₃) hay Poly Aluminium Chloride (PAC) được thêm vào nước để tạo ra kết tủa Al(OH)₃. Kết tủa này ở dạng bông keo, sẽ hấp phụ và kéo theo các tạp chất hữu cơ, vi sinh vật lơ lửng, giúp làm trong nước. Đây là một trong những ứng dụng quan trọng nhất của ngành hóa chất xử lý nước.
- Sản xuất công nghiệp: Dùng để tách và tinh chế các kim loại từ quặng hoặc dung dịch. Ví dụ, điều chế Magie hidroxit (Mg(OH)₂) từ nước biển bằng cách cho tác dụng với vôi tôi Ca(OH)₂.
- Sản xuất Pigment: Nhiều chất màu (pigment) sử dụng trong ngành sơn, mực in và nghệ thuật là các hợp chất kết tủa có màu sắc rực rỡ và bền màu.
Câu Hỏi Thường Gặp (FAQ)
Phần này giải đáp các thắc mắc phổ biến nhất như sự khác biệt giữa “kết tủa” và “lắng đọng”, cách tính toán độ tan từ hằng số Ksp, và các ứng dụng công nghệ cao của hiện tượng kết tủa trong tương lai gần.
1. Chất kết tủa và sự lắng đọng khác nhau như thế nào?
Chất kết tủa là quá trình hình thành chất rắn từ một phản ứng hóa học trong dung dịch. Trong khi đó, lắng đọng chỉ đơn thuần là quá trình các hạt rắn (có thể đã tồn tại sẵn, không nhất thiết do phản ứng tạo ra) lắng xuống dưới tác dụng của trọng lực.
2. Làm thế nào để tính độ tan từ Tích số tan (Ksp)?
Độ tan (S) là nồng độ mol của chất tan trong dung dịch bão hòa. Mối liên hệ giữa S và Ksp phụ thuộc vào công thức hóa học của chất điện li ít tan. Ví dụ, với AgCl (phân li ra 1 ion Ag⁺ và 1 ion Cl⁻):
Ksp = [Ag⁺][Cl⁻] = S × S = S²
Suy ra, S = √Ksp. Cập nhật đến 2025, Ksp của AgCl là khoảng 1.77 x 10⁻¹⁰, vậy độ tan của nó là S ≈ 1.33 x 10⁻⁵ M.
3. Ứng dụng mới nhất của kết tủa vào năm 2025 là gì?
Hiện nay, kỹ thuật kết tủa có kiểm soát (controlled precipitation) đang được nghiên cứu và ứng dụng mạnh mẽ trong lĩnh vực công nghệ nano. Phương pháp này cho phép tạo ra các hạt nano có kích thước và hình dạng đồng nhất với độ chính xác cao, phục vụ cho sản xuất pin lithium-ion thế hệ mới có mật độ năng lượng cao hơn 30%, các loại chất xúc tác hiệu suất cao và trong hệ thống dẫn truyền thuốc y sinh.
Người kiểm duyệt nội dung
PGS.TS Đặng Hoàng Phú
Cố vấn chuyên môn cấp cao tại Hóa Chất Doanh Tín. Phó Giáo sư, Giảng viên Khoa Hóa học (ĐH KHTN ĐHQG-HCM) với hơn 10 năm kinh nghiệm nghiên cứu Hóa hữu cơ & Phổ nghiệm.
Xem hồ sơ năng lực & công bố khoa học →





