Kiến thức chuyên môn
Hiđroxit Lưỡng Tính Là Gì? Tính Chất & Ứng Dụng Công Nghiệp
Trong lĩnh vực hóa học, khái niệm “lưỡng tính” luôn là một chủ đề hấp dẫn, đặc biệt khi nói về các hiđroxit. Câu hỏi “hiđroxit lưỡng tính là gì?” không chỉ là kiến thức nền tảng trong chương trình giáo dục mà còn là chìa khóa để mở ra nhiều ứng dụng quan trọng trong công nghiệp. Tại Hóa Chất Doanh Tín, với kinh nghiệm và chuyên môn kỹ thuật, chúng tôi không chỉ cung cấp sản phẩm mà còn mong muốn chia sẻ những kiến thức chuyên sâu, giúp quý khách hàng hiểu rõ bản chất và tối ưu hóa việc sử dụng các hợp chất này.
Bài viết này sẽ cung cấp một cái nhìn toàn diện, từ định nghĩa cơ bản, cơ chế hóa học, đến các ứng dụng thực tiễn của những hiđroxit lưỡng tính phổ biến như Al(OH)₃ và Zn(OH)₂.
Hiểu Đúng Về Hiđroxit Lưỡng Tính Là Gì?
Hiđroxit lưỡng tính là hiđroxit có khả năng tác dụng được với cả dung dịch axit và dung dịch bazơ, do nó có thể phân ly theo cả hai kiểu này.
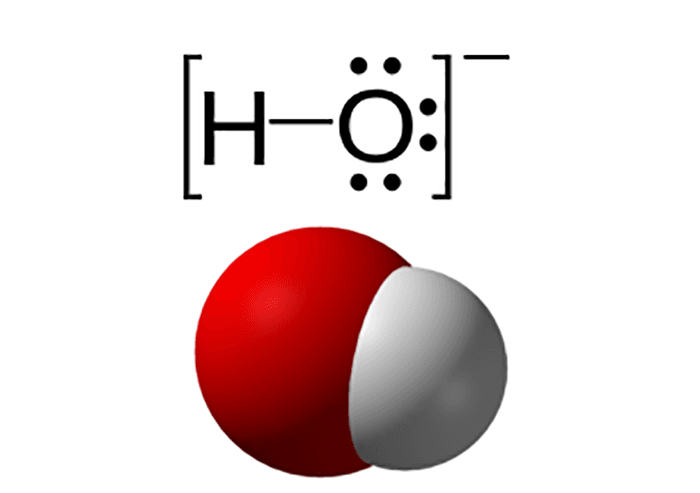
Để hiểu rõ hiđroxit lưỡng tính, trước tiên chúng ta cần định nghĩa các khái niệm cơ bản.
Hiđroxit và Tính Bazơ Đặc Trưng
Hiđroxit là hợp chất chứa nhóm OH⁻. Theo thuyết A-rê-ni-ut, nó có tính bazơ vì khi tan trong nước sẽ phân ly ra ion OH⁻.
Hiđroxit là một hợp chất vô cơ chứa anion hiđroxit (OH⁻). Theo thuyết A-rê-ni-ut kinh điển, một bazơ là chất khi tan trong nước sẽ phân ly ra ion OH⁻, một quá trình đặc trưng của các chất điện li. Ví dụ, Natri hiđroxit (NaOH) là một bazơ mạnh điển hình:
NaOH ⟶ Na⁺ + OH⁻
Sự hiện diện của ion OH⁻ tự do này quyết định tính kiềm của dung dịch.
Định Nghĩa Chuẩn Xác về Hiđroxit Lưỡng Tính
Hiđroxit lưỡng tính vừa có thể phân ly như một axit yếu (cho H⁺), vừa có thể phân ly như một bazơ yếu (cho OH⁻).
Hiđroxit lưỡng tính là một hiđroxit có khả năng tác dụng được với cả dung dịch axit và dung dịch bazơ, đây là một dạng đặc biệt của phản ứng trung hòa. Điều này có nghĩa là, trong môi trường nước, chúng vừa có khả năng phân ly như một axit yếu (cho ion H⁺), vừa có khả năng phân ly như một bazơ yếu (cho ion OH⁻).
Góc nhìn chuyên gia – Nguyễn Thị Mỹ Linh (Trưởng phòng R&D, Hóa Chất Doanh Tín):
“Bản chất lưỡng tính không phải là một ‘tính chất ma thuật’. Nó xuất phát từ sự cân bằng tinh tế về độ âm điện giữa nguyên tử kim loại (M), Oxi và Hydro. Khi liên kết M-O có độ phân cực tương đương với liên kết O-H, phân tử sẽ ‘linh hoạt’ trong việc lựa chọn phá vỡ liên kết nào tùy thuộc vào môi trường xung quanh.”
Cơ Chế Hoạt Động và Phương Trình Điện Li
Cơ chế của hiđroxit lưỡng tính là khả năng phân ly theo 2 chiều hướng: kiểu axit (tạo H⁺) và kiểu bazơ (tạo OH⁻), được minh họa qua các phương trình điện li.
Để minh họa rõ hơn, hãy xem xét cơ chế điện li của Kẽm hiđroxit (Zn(OH)₂), một ví dụ tiêu biểu. Kẽm (Zn) là một nguyên tố kim loại chuyển tiếp có nhiều hợp chất quan trọng.
Khi thể hiện tính bazơ (phân ly trong môi trường axit):
Zn(OH)₂ ⇌ Zn²⁺ + 2OH⁻
Khi thể hiện tính axit (phân ly trong môi trường kiềm):
Zn(OH)₂ ⇌ 2H⁺ + ZnO₂²⁻
Chính vì khả năng linh hoạt này, Zn(OH)₂ có thể phản ứng với cả hai loại dung dịch:
Tác dụng với axit mạnh (HCl): Zn(OH)₂ + 2HCl ⟶ ZnCl₂ + 2H₂O
Tác dụng với bazơ mạnh (NaOH): Zn(OH)₂ + 2NaOH ⟶ Na₂[Zn(OH)₄] (Natri tetrahydroxozincat)
Các hóa chất như Axit clohidric (HCl) 32% và Xút vảy (NaOH) 99% là những thuốc thử không thể thiếu trong phòng thí nghiệm để chứng minh tính chất này.
Danh Sách Các Hiđroxit Lưỡng Tính Thường Gặp
Các hiđroxit lưỡng tính thường gặp nhất là: Zn(OH)₂, Al(OH)₃, Sn(OH)₂, Pb(OH)₂ và Cr(OH)₃.
Bảng dưới đây tổng hợp các hiđroxit lưỡng tính quan trọng nhất trong công nghiệp và học thuật.
| Tên Gọi | Công Thức | Hóa Trị Kim Loại | Màu Sắc Kết Tủa |
|---|---|---|---|
| Nhôm hiđroxit | Al(OH)₃ | III | Trắng keo |
| Kẽm hiđroxit | Zn(OH)₂ | II | Trắng |
| Thiếc(II) hiđroxit | Sn(OH)₂ | II | Trắng |
| Chì(II) hiđroxit | Pb(OH)₂ | II | Trắng |
| Crom(III) hiđroxit | Cr(OH)₃ | III | Lục xám |
Ứng Dụng Công Nghiệp Then Chốt Của Hiđroxit Lưỡng Tính
Al(OH)₃ được dùng làm chất chống cháy, sản xuất nhôm, dược phẩm. Zn(OH)₂ được dùng trong ngành cao su, gốm sứ và xử lý nước.
Đây chính là phần giá trị nhất, kết nối lý thuyết với thực tiễn sản xuất.
Al(OH)₃ – “Người Hùng Thầm Lặng” Trong Ngành Nhựa và Vật Liệu Chống Cháy
- Chất chống cháy không halogen: Theo các dự báo cho thị trường Việt Nam đến năm 2025, nhu cầu về phụ gia chống cháy thân thiện môi trường cho ngành xây dựng và điện tử được dự báo có tốc độ tăng trưởng kép hàng năm (CAGR) đạt 5.2%. Al(OH)₃ là lựa chọn hàng đầu vì khi bị nung nóng, nó phân hủy thành Al₂O₃, một loại oxit lưỡng tính, đồng thời giải phóng hơi nước giúp dập tắt ngọn lửa.
- Sản xuất Nhôm và hợp chất Nhôm: Al(OH)₃ là sản phẩm trung gian trong quy trình Bayer để tinh chế quặng bauxite thành alumina (Al₂O₃), nguyên liệu chính để sản xuất nhôm.
- Ngành dược phẩm: Với độ tinh khiết cao, Al(OH)₃ được dùng làm hoạt chất trong các thuốc kháng axit (antacid).
Zn(OH)₂ và Ứng Dụng Trong Các Lĩnh Vực Khác
- Ngành cao su: Kẽm hiđroxit được sử dụng làm chất hoạt hóa trong quá trình lưu hóa cao su, một ứng dụng quan trọng của công nghệ polymer.
- Sản xuất gốm sứ và thủy tinh: Đóng vai trò là chất trợ dung, giúp cải thiện chất lượng sản phẩm.
- Xử lý nước: Zn(OH)₂ có thể được sử dụng trong một số quy trình xử lý. Đây là một phần quan trọng trong lĩnh vực cung cấp hóa chất xử lý nước của chúng tôi.
Case Study từ Doanh Tín
Dự án: Cung cấp Zn(OH)₂ cho nhà máy sản xuất găng tay y tế tại Long An.
Thách thức: Khách hàng cần một nguồn cung ổn định với kích thước hạt siêu mịn để tối ưu hóa tốc độ phản ứng lưu hóa.
Giải pháp: Đội ngũ kỹ thuật của Doanh Tín đã tư vấn và cung cấp lô sản phẩm Zn(OH)₂ được nghiền mịn theo yêu cầu, giúp khách hàng giảm 10% thời gian lưu hóa và tăng 5% độ bền của sản phẩm.
Phân Biệt Hiđroxit Lưỡng Tính và Các Khái Niệm Liên Quan
Cần phân biệt hiđroxit lưỡng tính với oxit lưỡng tính (ví dụ ZnO) và hợp chất lưỡng tính (khái niệm rộng hơn, bao gồm cả amino axit).
Hiđroxit Lưỡng Tính vs. Oxit Lưỡng Tính: Một kim loại tạo ra oxit lưỡng tính (ví dụ ZnO) cũng thường tạo ra hiđroxit lưỡng tính tương ứng (Zn(OH)₂).
Hiđroxit Lưỡng Tính vs. Hợp Chất Lưỡng Tính: “Hợp chất lưỡng tính” là thuật ngữ rộng hơn, bao gồm cả amino axit. Glycin là một ví dụ điển hình với cả nhóm axit (-COOH) và nhóm bazơ (-NH₂).
Tiêu Chuẩn Kỹ Thuật và An Toàn Khi Sử Dụng
Khi sử dụng, cần chú trọng đến các tiêu chuẩn chất lượng (TCVN/ISO) và tuân thủ tuyệt đối các quy định về an toàn hóa chất như Nghị định 113/2017/NĐ-CP.
Đối với khách hàng B2B, chất lượng và an toàn là yếu tố hàng đầu. Việc bảo quản hóa chất phải tuân thủ nghiêm ngặt các quy định của pháp luật.
Tiêu chuẩn chất lượng (TCVN/ISO): Các thông số như độ tinh khiết, kích thước hạt, độ trắng là cực kỳ quan trọng.
An toàn hóa chất: Việc sử dụng và vận chuyển phải tuân thủ các quy định trong Nghị định 113/2017/NĐ-CP và các cập nhật mới nhất của Luật Hóa chất 2025.
Câu Hỏi Thường Gặp (FAQ)
Câu 1: Làm thế nào để điều chế Zn(OH)₂ trong phòng thí nghiệm?
Trả lời: Bạn có thể nhỏ từ từ dung dịch NaOH vào dung dịch muối kẽm (như ZnSO₄). Kết tủa trắng Zn(OH)₂ sẽ xuất hiện. Lưu ý không dùng dư NaOH vì kết tủa sẽ tan ra.
Câu 2: Tất cả các hiđroxit của kim loại hóa trị III đều lưỡng tính phải không?
Trả lời: Không hoàn toàn. Al(OH)₃ và Cr(OH)₃ là lưỡng tính, nhưng Sắt(III) hiđroxit – Fe(OH)₃ chỉ thể hiện tính bazơ rất yếu.
Câu 3: Hóa Chất Doanh Tín có cung cấp Al(OH)₃ dùng cho ngành dược không?
Trả lời: Có. Chúng tôi cung cấp dòng sản phẩm Al(OH)₃ với độ tinh khiết cao, đáp ứng các tiêu chuẩn Dược điển Việt Nam.
Kết Luận
Hiểu rõ hiđroxit lưỡng tính là gì không chỉ dừng lại ở định nghĩa. Việc nắm bắt bản chất, các loại phổ biến, và đặc biệt là ứng dụng thực tiễn của chúng trong công nghiệp mới là kiến thức thực sự giá trị.
Nếu bạn có nhu cầu về các sản phẩm như Nhôm hiđroxit, Kẽm hiđroxit hoặc cần tư vấn kỹ thuật chuyên sâu, đừng ngần ngại liên hệ với đội ngũ chuyên gia của Hóa Chất Doanh Tín. Chúng tôi luôn sẵn sàng đồng hành cùng thành công của bạn.





