Kiến thức chuyên môn
Số Oxi Hóa Của Na: Toàn Tập Kiến Thức Từ Lý Thuyết Nền Tảng Đến Ứng Dụng An Toàn Trong Công Nghiệp
Bạn đang thắc mắc số oxi hóa của Na là bao nhiêu và làm thế nào để xác định nó một cách chính xác trong các hợp chất khác nhau? Trong bài viết này, chúng tôi sẽ cung cấp một hướng dẫn toàn diện, từ các quy tắc cơ bản đến những ví dụ thực tế, giúp bạn nắm vững kiến thức quan trọng này.
Natri (Na) là một kim loại kiềm hoạt động mạnh, và việc hiểu rõ trạng thái oxi hóa của nó là nền tảng để giải quyết nhiều bài toán hóa học phức tạp.
Số Oxi Hóa Của Na Là Bao Nhiêu?
Trong hầu hết các hợp chất, số oxi hóa của Natri (Na) luôn là +1. Khi ở trạng thái đơn chất (kim loại Na), số oxi hóa của nó là 0.
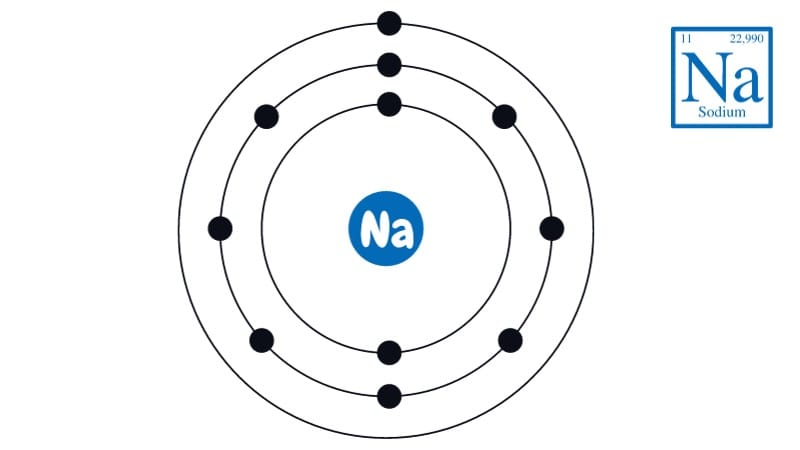
Lý do là vì Natri (Na) là một kim loại kiềm, nằm ở nhóm IA trong bảng tuần hoàn hóa học. Dữ liệu cập nhật đến năm 2025 cho thấy, cấu hình electron của Natri là [Ne] 3s¹, với chỉ 1 electron ở lớp ngoài cùng. Để đạt được cấu hình electron bền vững giống như khí hiếm Neon, Na có xu hướng nhường đi 1 electron này, tạo thành ion dương Na⁺. Chính vì vậy, số oxi hóa của nó trong hợp chất là +1.
Quy Tắc Vàng Để Xác Định Số Oxi Hóa Của Natri
Có 2 quy tắc bất biến:
1. Na ở dạng đơn chất: Số oxi hóa là 0.
2. Na trong hợp chất: Số oxi hóa là +1.
Để tránh nhầm lẫn, hãy luôn ghi nhớ 2 quy tắc đơn giản và không có ngoại lệ trong chương trình hóa học phổ thông sau:
- ✓
Khi Na ở dạng đơn chất: Số oxi hóa của Na là 0. Trạng thái này là khi Na tồn tại một mình, không liên kết với bất kỳ nguyên tố nào khác (ví dụ: trong một thỏi kim loại Natri). - ✓
Khi Na ở trong hợp chất: Số oxi hóa của Na là +1. Điều này áp dụng cho tất cả các hợp chất của Natri, từ muối ăn đơn giản đến các phân tử phức tạp.
Ví Dụ Thực Tế Về Cách Xác Định Số Oxi Hóa Của Na
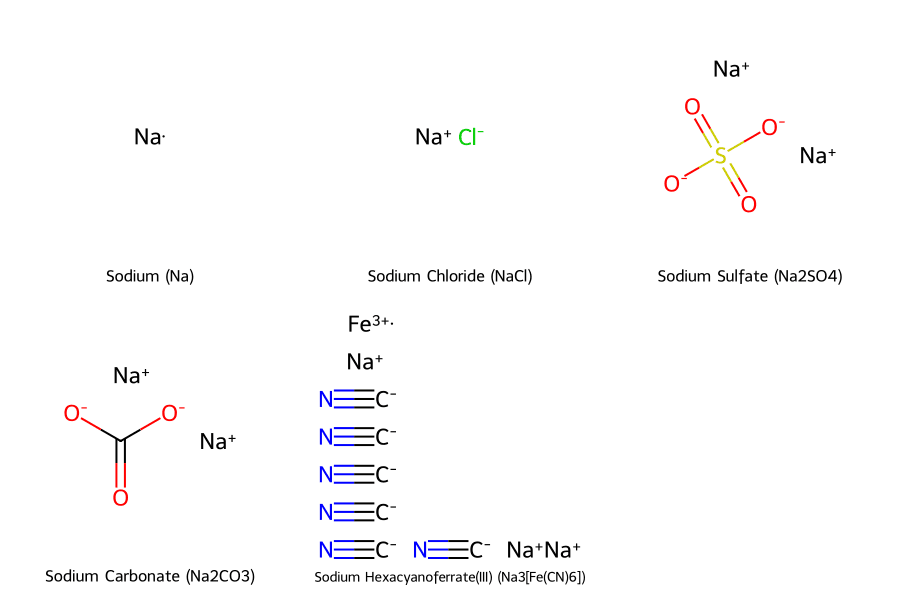
Trong các hợp chất phổ biến như NaCl, Na₂SO₄, và Na₂CO₃, số oxi hóa của Na luôn được mặc định là +1. Giá trị này được dùng làm cơ sở để tính toán số oxi hóa cho các nguyên tố còn lại trong phân tử.
Hãy cùng xem xét một vài hợp chất tiêu biểu để hiểu rõ hơn cách áp dụng quy tắc trên.
Hợp Chất Ion Đơn Giản: NaCl (Natri Clorua)
Đây là muối ăn quen thuộc. Trong hợp chất này, Na nhường 1 electron cho Cl. Đây là một ví dụ điển hình của liên kết ion.
- Na là kim loại kiềm, nên có số oxi hóa là +1.
- Cl là halogen, nhận 1 electron, nên có số oxi hóa là -1.
- Kiểm tra: Tổng số oxi hóa trong phân tử = (+1) + (-1) = 0. Phân tử NaCl trung hòa về điện, vì vậy cách xác định này hoàn toàn chính xác.
Hợp Chất Phức Tạp Hơn: Na₂SO₄ (Natri Sunfat)
Trong phân tử này, chúng ta có 3 nguyên tố. Ta sẽ lấy các giá trị đã biết để tìm giá trị chưa biết (của S):
- Na: Luôn là +1.
- O: Thường có số oxi hóa là -2.
- S: Cần tìm.
Gọi số oxi hóa của Lưu huỳnh (S) là x. Vì tổng số oxi hóa trong một phân tử trung hòa bằng 0, ta có phương trình:
2 * (+1) + x + 4 * (-2) = 0
2 + x – 8 = 0
x = +6
Vậy, trong Na₂SO₄, số oxi hóa của Na là +1, của S là +6 và của O là -2.
3. Một Ví Dụ Khác: Na₂CO₃ (Natri Cacbonat)
Tương tự, ta xác định số oxi hóa của các nguyên tố trong Na₂CO₃:
Gọi số oxi hóa của Cacbon (C) là y, ta có:
2 * (+1) + y + 3 * (-2) = 0
2 + y – 6 = 0
y = +4
Vậy, trong Na₂CO₃, số oxi hóa của Na là +1, của C là +4 và của O là -2.
Câu Hỏi Thường Gặp (FAQs)
Số oxi hóa của Na có bao giờ khác +1 không?
Không. Trong chương trình học và các ứng dụng thực tế, số oxi hóa của Na trong hợp chất luôn là +1. Các trường hợp ngoại lệ (như natride Na⁻) cực kỳ hiếm và chỉ tồn tại trong điều kiện phòng thí nghiệm khắc nghiệt.
Làm thế nào để nhớ nhanh quy tắc này?
Ghi nhớ câu: “Kim loại kiềm, hợp chất cộng một, đơn chất thì không”. Tức là các kim loại kiềm (nhóm IA) như Na, K, Li khi ở trong hợp chất luôn có số oxi hóa +1, còn khi là đơn chất thì bằng 0.
Tại sao việc xác định số oxi hóa lại quan trọng?
Đây là bước nền tảng và bắt buộc để cân bằng các phương trình phản ứng oxi hóa-khử, một dạng phản ứng chiếm phần lớn trong hóa học vô cơ và hữu cơ.
Kết Luận
Việc xác định số oxi hóa của Na rất đơn giản: nó bằng 0 khi ở dạng kim loại đơn chất và luôn là +1 trong mọi hợp chất hóa học. Bằng cách nắm vững quy tắc này và luyện tập qua các ví dụ, bạn có thể tự tin giải quyết các bài toán liên quan một cách nhanh chóng và chính xác.
Nếu bạn đang có nhu cầu tìm mua các loại hóa chất công nghiệp hoặc hóa chất thí nghiệm, hãy ghé thăm cửa hàng hóa chất của Hóa Chất Doanh Tín để được tư vấn và nhận báo giá tốt nhất.





